



所属成套资源:人教版 (新课标)化学选修4 化学反应原理:课件
2020-2021学年第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件
展开
这是一份2020-2021学年第二章 化学反应速率和化学平衡第三节 化学平衡教学ppt课件,共19页。PPT课件主要包含了化学平衡的特征,逆等动定变,化学反应速率,催化剂,催化剂的影响等内容,欢迎下载使用。
【复习】化学平衡状态的概念
一定条件下,可逆反应里,正反应速率和逆反应速率相等,反应混合物中各组分的浓度保持不变的状态。
——可逆反应——v正 =v逆——动态平衡。达平衡后,正逆反应仍在进行(v正=v逆≠0)——平衡时,各组分浓度、含量保持不变(恒定)——条件改变,平衡发生改变(移动)
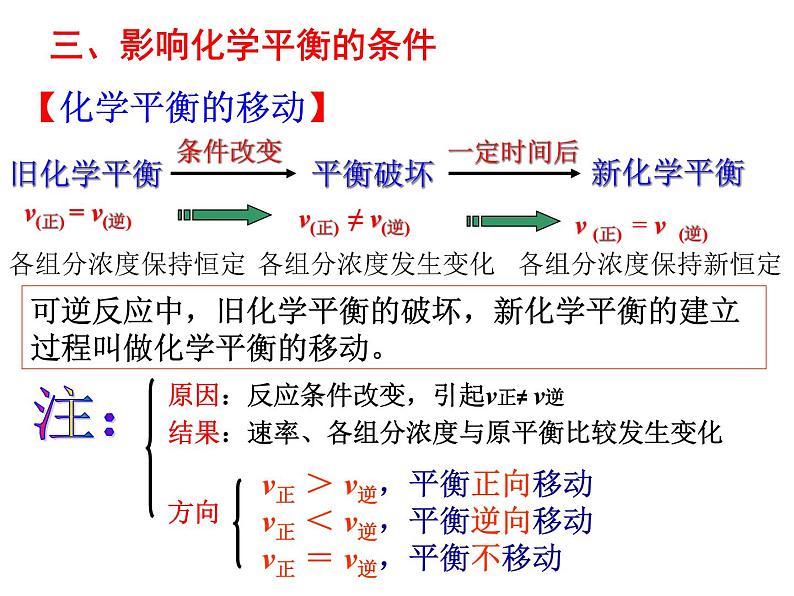
三、影响化学平衡的条件
v(正) = v(逆)
v(正) ≠ v(逆)
v (正) = v (逆)
可逆反应中,旧化学平衡的破坏,新化学平衡的建立过程叫做化学平衡的移动。
v正 > v逆,平衡正向移动v正 < v逆,平衡逆向移动v正 = v逆,平衡不移动
原因:反应条件改变,引起v正≠ v逆
结果:速率、各组分浓度与原平衡比较发生变化
【回忆】影响化学反应速率的外界条件主要有哪些?
如何通过改变条件来打破旧平衡?
可通过改变影响反应速率的条件来打破原有平衡,建立新平衡。
1、浓度的影响其它条件不变的情况下,增大反应物浓度或减小生成物浓度,平衡均向 方向移动;增大生成物浓度或减小反应物浓度,平衡均向 方向移动。
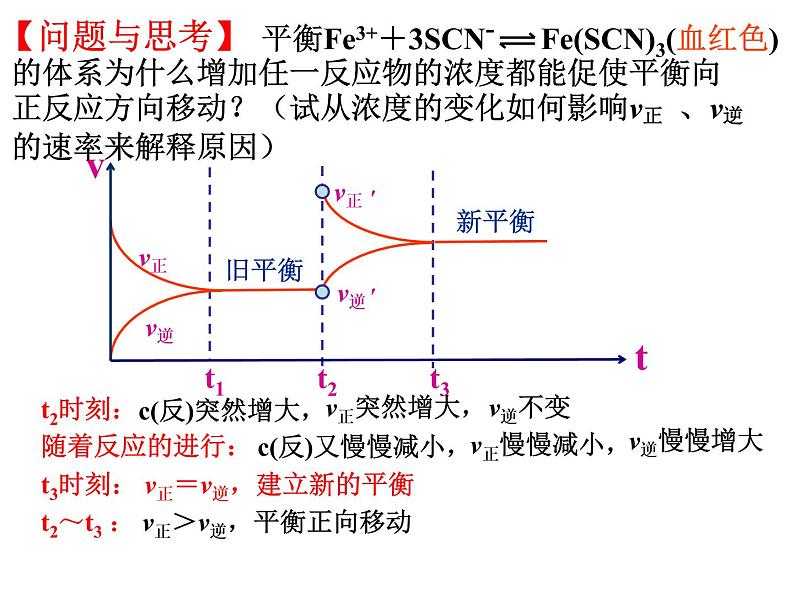
t2~t3 : v正>v逆,平衡正向移动
t3时刻: v正=v逆,建立新的平衡
平衡Fe3++3SCN- Fe(SCN)3(血红色)
的体系为什么增加任一反应物的浓度都能促使平衡向正反应方向移动?(试从浓度的变化如何影响v正 、v逆的速率来解释原因)
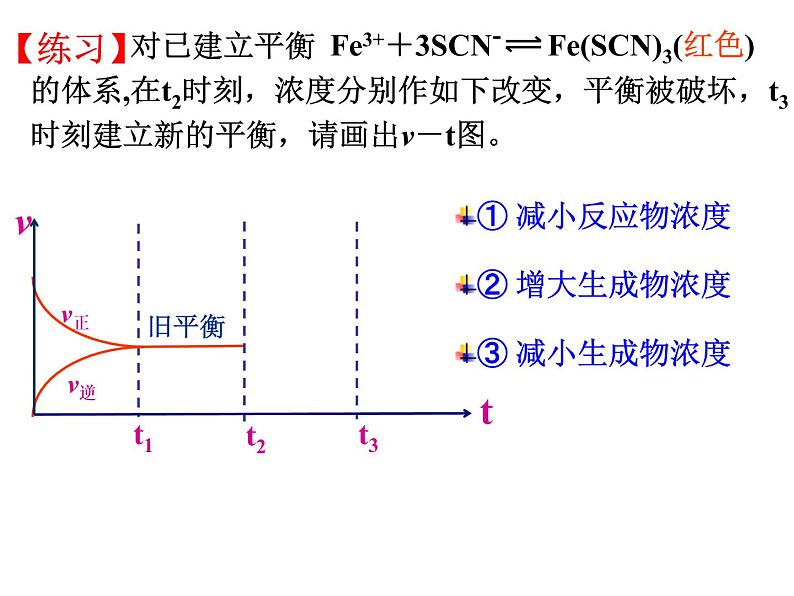
对已建立平衡 的体系,在t2时刻,浓度分别作如下改变,平衡被破坏,t3时刻建立新的平衡,请画出v-t图。
① 减小反应物浓度② 增大生成物浓度③ 减小生成物浓度
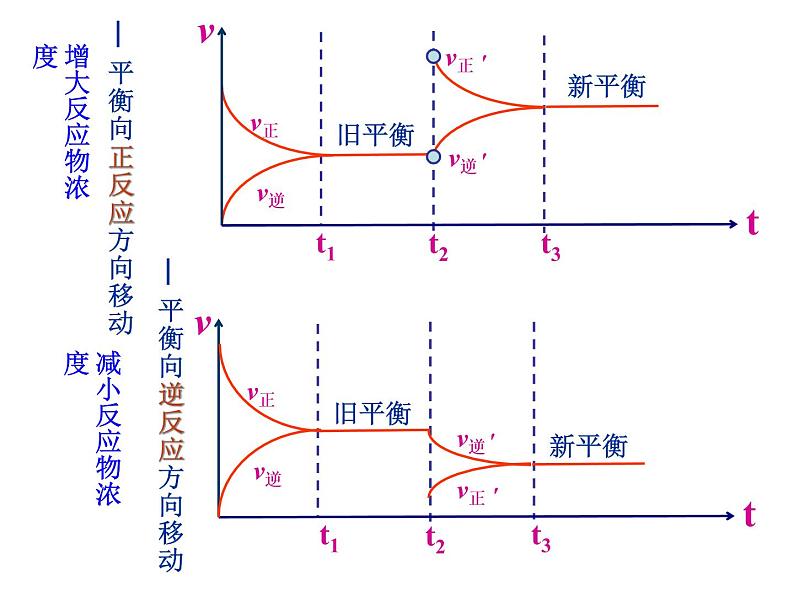
— 平衡向逆反应方向移动
— 平衡向正反应方向移动
——平衡向逆反应方向移动
——平衡向正反应方向移动
2、温度:其它条件不变的情况下,升高温度,平衡向 方向移动,降低温度,平衡向 方向移动
1、对已建立的平衡体系: 2NO2(气) N2O4(气) (正反应为放热反应) t2时刻,升高温度的瞬间,v正 和v逆还相等吗? 2、随着时间的推移,v正和v逆如何变化? 最后二者关系怎样?
速率-时间关系图温度对化学平衡的影响
对于反应前后气体总体积相等的反应
A(g) + B (g) 2C (g) + D (s)
改变压强,平衡都不发生移动
改变压强对化学平衡的影响
aA(g)+bB(g) cC(g)
(2) 对于反应前后气体总体积相等的反应增大压强正逆反应速率均增大,但增大倍数相同, v正= v逆,平衡不移动。(3)平衡混合物都是固体和液体的反应(“无气反应”),改变压强,平衡不移动;
(1)在其它条件不变时, 增大压强,平衡向气体体积缩小的方向移动;减小压强,平衡向气体体积增大的方向移动。
加入催化剂能同等程度的加快反应速率,所以平衡不移动,但能缩短达到平衡的时间。
增大反应物浓度,平衡向正反应方向移动,减小反应物浓度,平衡向逆反应方向移动,升高温度,平衡向吸热反应方向移动,降低温度,平衡向放热反应方向移动,
即平衡向减弱反应物浓度增加的方向移动;
即平衡向减弱反应物浓度减小的方向移动;
即平衡向减弱温度升高的方向移动;
即平衡向减弱温度降低的方向移动。
相关课件
这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡评课课件ppt,共11页。PPT课件主要包含了决定于生成物浓度,决定于反应物浓度,可逆反应的特点,过程分析,逐渐减小,逐渐增大,化学平衡状态,可逆反应,前提条件,v正=v逆等内容,欢迎下载使用。
这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 化学平衡集体备课ppt课件,共32页。PPT课件主要包含了探究汇报,红色变深,红色变浅,橙色变深,黄色变深,化学平衡的移动,条件改变,一定时间后等内容,欢迎下载使用。
这是一份高中化学第二章 化学反应速率和化学平衡第三节 化学平衡课文内容课件ppt,共55页。PPT课件主要包含了问题一,v正=v逆,化学平衡,化学平衡状态,思考与交流,身边的平衡现象,巩固练习等内容,欢迎下载使用。










