
化学人教版 (新课标)第三节 电解池课堂教学课件ppt
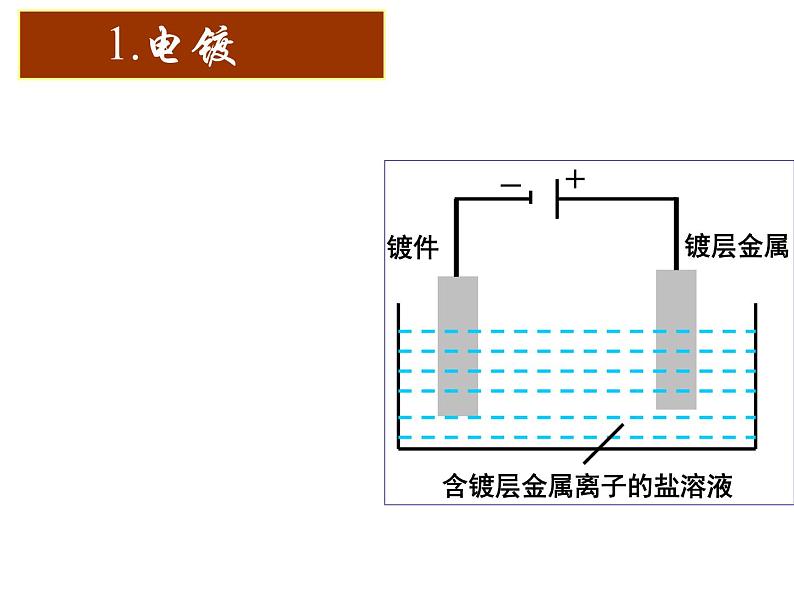
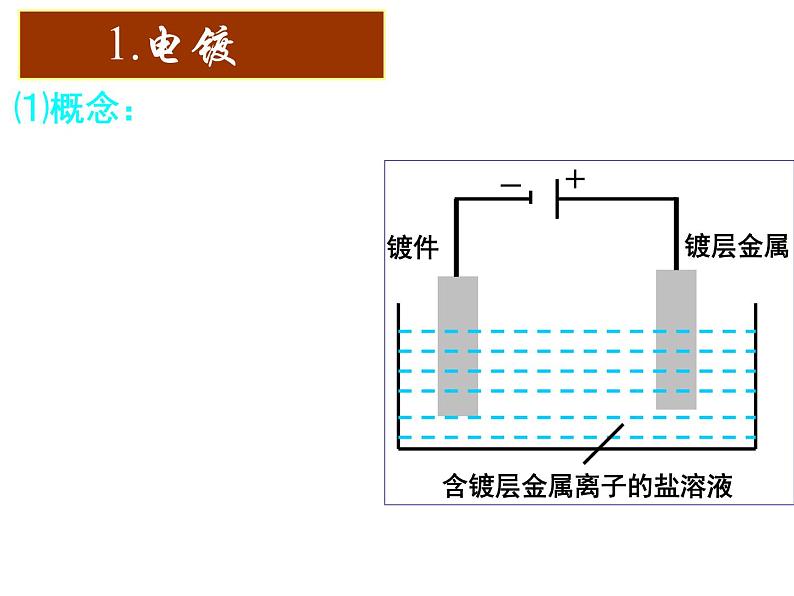
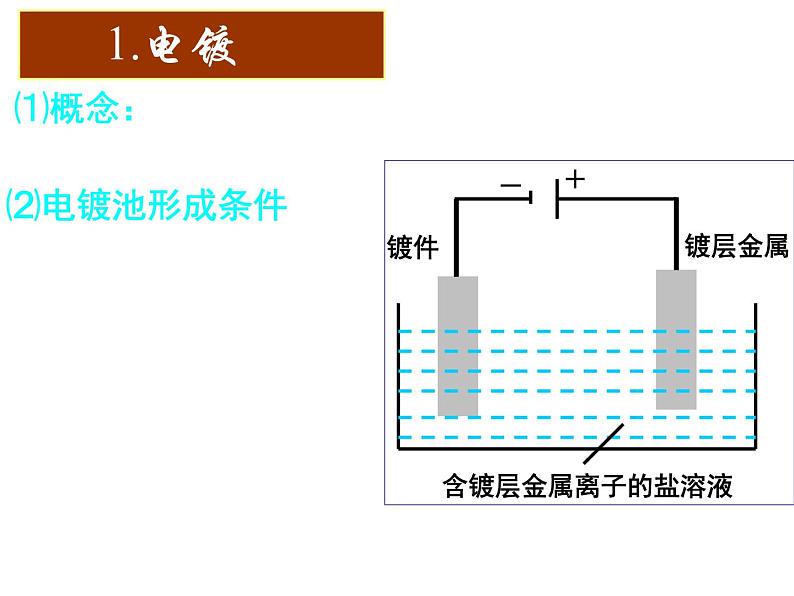
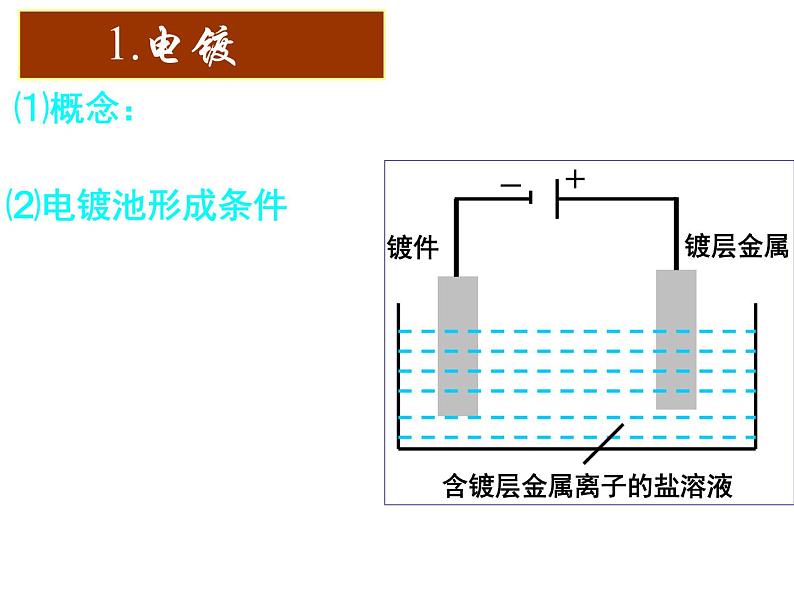
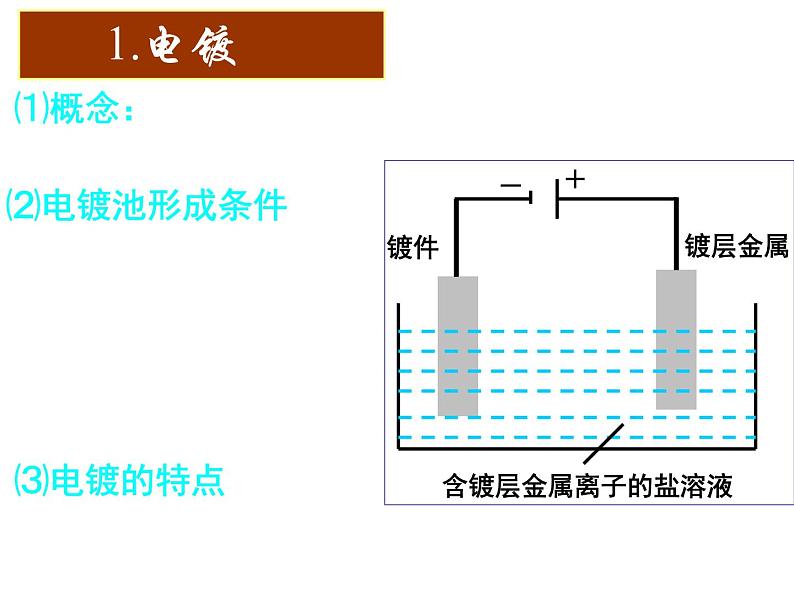
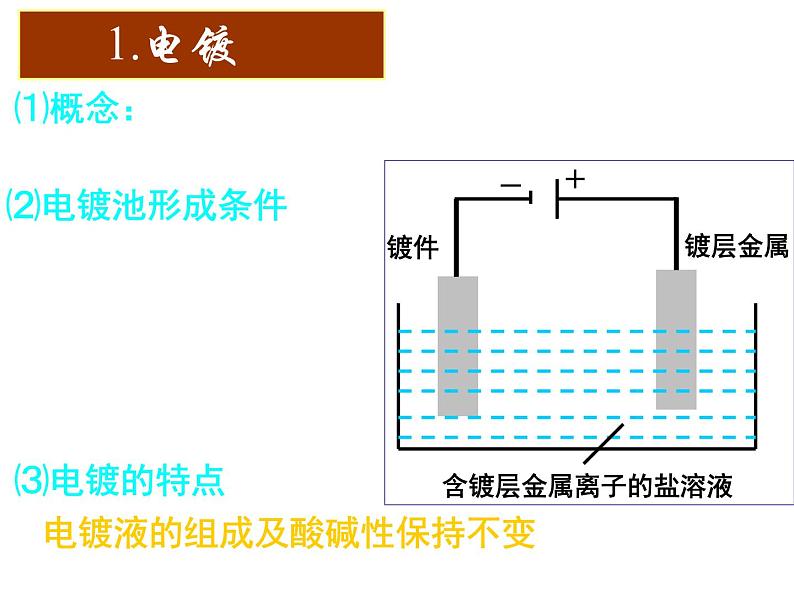
展开⑴概念:应用电解原理在某些金属表面镀上一层其它金属或合金的过程。
③含镀层金属阳离子的盐溶液作电解液
电镀液的组成及酸碱性保持不变
Zn、Fe、Ni、Ag、Au等
以粗铜为阳极,以纯铜为阴极, 以CuSO4溶液为电解液进行电解
阳极: Zn -2e-=Zn2+ Fe-2e-=Fe2+ Ni -2e-=Ni2+ Cu-2e-=Cu2+
阴极: Cu2+ +2e-=Cu
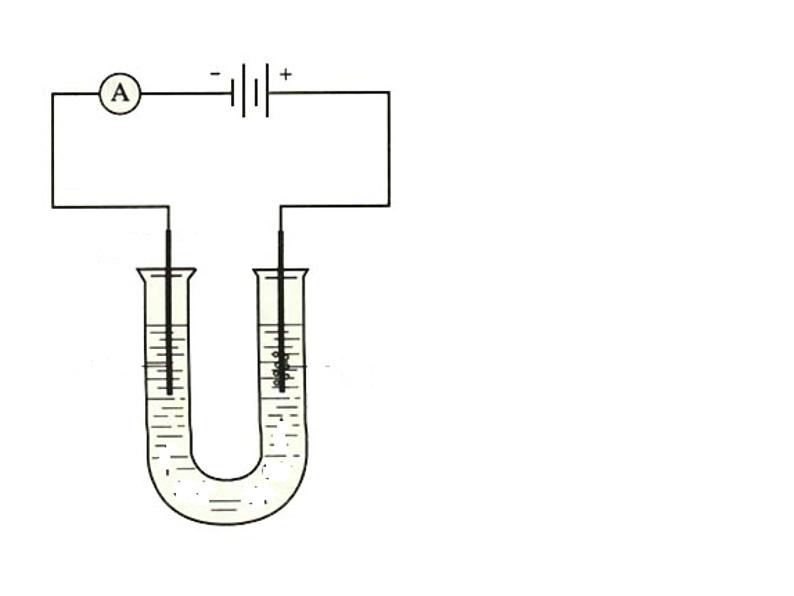
(1)在NaCl溶液中,NaCl电离出____________,H2O电离出____________。 通电后,在电场的作用下, _________向阴极移动, __________向阳极移动。 在阳极,由于________容易失去电子,被氧化生成________。 阳极方程式: __________________;
2Cl- - 2e- = Cl2
(2)在阴极,由于__________容易得到电子被还原生成__________. 使H2O 电离向右移动,因此阴极__________浓度增大,PH __________。 阴极方程式:____________________。
2H+ + 2e- = H2
总化学方程式: 总离子方程式:
(3)电解前向溶液中滴加酚酞,通电后现象为:______________________________,两极极板上都有气体产生,如何检验气体的种类?
阴极附近的溶液无色变为红色
阳极:把湿润的碘化钾淀粉试纸放在阳极 附近,产生气体可以使湿润KI淀粉 试纸变蓝色。
由于粗盐中含有泥沙、Ca2+ 、Mg2+、 Fe3+ 、SO42—等杂质,会在碱液中形成沉淀从而损坏离子交换膜,那么如何除去这些杂质呢?
3. 所有试剂只有过量才能除尽,你能设计一个 合理的顺序逐一除杂吗?
2. 用什么试剂除去Ca2+ 、Mg2+、 Fe3+ 、SO42—
1. 用什么方法除去泥沙?
泥沙、Na+、 Cl-、Mg2+、 Ca2+、 Fe3+ 、SO42-
Na+、 Cl-、 .Mg2+、 Ca2+、 Fe3+ 、 SO42-
略过量BaCl2 溶液
Na+、 Cl-、 Mg2+、 Ca2+、 Fe3+ 、引入Ba2+
除Fe3+ , Mg2+
Na+、 Cl-、 Ca2+ 、 Ba2+ 、引入OH-
略过量Na2CO3 溶液
除Ca2+. Ba2+
Na+、 Cl-、CO32-、OH-
调节PH 除CO32- 、OH-
4.电冶金(冶炼活泼金属钠、镁、铝等)
电解熔融状态的氯化钠。
2Cl - -2e- == Cl2↑
2Na+ + 2e- == 2Na
2NaCl(熔融) 2Na + Cl2 ↑
结论:电解法是冶炼金属的一种重要方 法,是最强有力的氧化还原的手段。
原电池、电解池、电镀池判定规律
若无外接电源, 可能是原电池,然后依据原电池的形成条件分析判定,主要思路是“三看” 先看电极:两极为导体且活泼性不同 再看溶液:两极插入电解质溶液中 后看回路:形成闭合回路或两极接触 若有外接电源,两极插入电解质溶液中,则可能是电解池或电镀池。当阳极金属与电解质溶液中的金属阳离子相同,则为电镀池,其余情况为电解池。
讨论:比较电解池和原电池的异同~~~~~~
发生氧化还原反应,从而形成电流
电流通过引起氧化还原反应
两个电极、电解质溶液或熔融态电解质、形成闭合回路、自发发生氧化还原反应
电源、电极(惰性或非惰性)、电解质(水溶液或熔融态)
由电极本身决定 正极:流入电子 负极:流出电子
由外电源决定 阳极:连电源正极 阴极:连电源负极
(外电路)负极 → 正极
电源负极→阴极→阳极→电源正极
电源正极→阳极→阴极→电源负极
负极:Zn - 2e- =Zn2+ (氧化反应)正极:2H+ + 2e- =H2↑(还原原应)
阳极:2 CI- - 2e- = CI2 ↑ (氧化反应)阴极: Cu2+ + 2e- = Cu (还原反应)
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池评课课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池评课课件ppt,共17页。PPT课件主要包含了他们怎么如此便宜呢,探究实验4-2,实验结果交流,实验记录,电解池,电解原理,电极名称,和原电池正极相连,和原电池负极相连,异性相吸等内容,欢迎下载使用。
人教版 (新课标)第三节 电解池教课内容课件ppt: 这是一份人教版 (新课标)第三节 电解池教课内容课件ppt,共3页。PPT课件主要包含了概念形成,以氯化铜为例等内容,欢迎下载使用。
高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池图文ppt课件: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第三节 电解池图文ppt课件,共5页。PPT课件主要包含了电解原理的应用,电冶金,制取金属钠,通直流电后,总反应,Cu2+,Cl2,电解精炼铜原理等内容,欢迎下载使用。













