





人教版 (2019)选择性必修2第一节 原子结构评课课件ppt
展开2.基态与激发态 原子光谱
3.构造原理与电子排布式
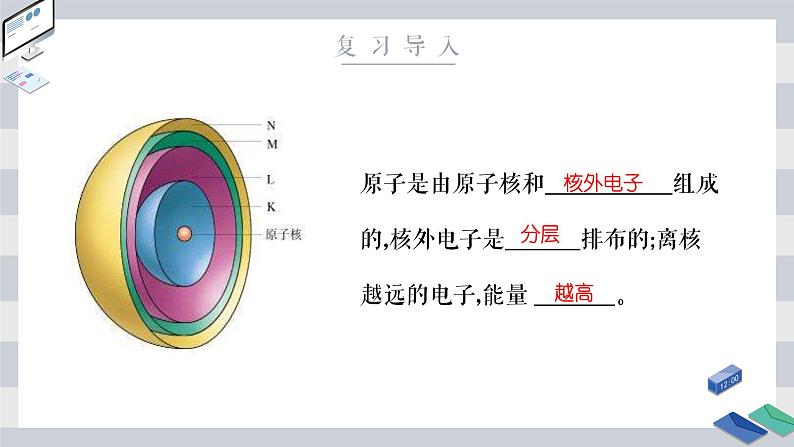
原子是由原子核和 组成的,核外电子是 排布的;离核越远的电子,能量 。
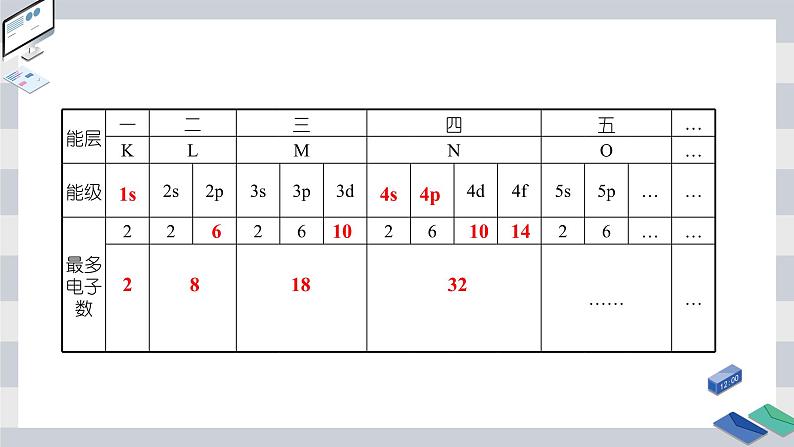
能层:核外电子按 不同分成能层,能层序数1、2、3、4、5、6、7分别用 、 、 、N、O、P、Q表示。能层越高,电子的能量 ,能量的高低顺序为E(K)
能层与能级的组成以及能量的关系
(1)任一能层,能级数=能层序数,且总是从s能级开始。(2)各能级最多容纳的电子数为以s、p、d、f……排序的自然数1、3、5、7……的2倍。(3)每一能层中最多容纳的电子数为2n2(n代表能层序数)。
(4)不同能层中符号相同的能级所容纳的最多电子数相同。(5)能层或能级的能量关系。(6)不同能层中不同能级的能量高低顺序(按构造原理排序,存在能级交错):ns<(n-2)f<(n-1)d
相反,电子从较高能量的激发态跃迁到较低能量的激发态乃至基态时,将 能量。光(辐射)是电子跃迁 能量的重要形式。
①原子光谱:不同元素的原子,电子发生跃迁时会吸收或释放不同的光,可以用光谱仪摄取各种元素原子的 光谱或 光谱,总称原子光谱。
②光谱分析:现代化学中,常利用原 子光谱上的 来 鉴定元素,称为光谱分析。
提示:激发态原子中的电子跃迁到低能级时,多余的能量以 光的形式释放出来。
构造原理:以光谱学事实为基础,从氢开始,随核电荷数递增,新增电子填入能级的顺序称为 。
1.用数字在能级符号的右上角标明该能级上排布的 ,这就是电子排布式,例如K:1s22s22p63s23p64s1。
练习:氢、氮、氧、钠、氯的电子排布式分别为 、 、 、 、 。
1s22s22p63s1
1s22s22p63s23p5
2.为了避免电子排布式的书写过于繁琐,把内层电子达到稀有气体元素原子结构的部分以相应稀有气体的元素符号外加方括号的形式表示,例如K:[Ar]4s1。
3.随核电荷数递增,电子并不总是填满一个能层后再开始填入下一个能层,如电子是按3p→4s→3d的顺序而不是按3p→ → 的顺序填充的,这种现象被称为 。基态铬、铜的核外电子排布不符合构造原理,Cr、Cu基态原子的电子排布式分别为 、 。
1s22s22p63s23p63d54s1
1s22s22p63s23p63d104s1
高中化学人教版 (2019)选择性必修2第一节 原子结构图文ppt课件: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构图文ppt课件,共43页。
人教版 (2019)选择性必修2第一节 原子结构教学课件ppt: 这是一份人教版 (2019)选择性必修2第一节 原子结构教学课件ppt,共50页。PPT课件主要包含了第一节原子结构,课前·新知导学,pdf,能级交错,d54s1,d104s1,课堂·重难探究,重难突破,典例精练,课堂小结等内容,欢迎下载使用。
高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套课件ppt: 这是一份高中化学人教版 (2019)选择性必修2第一节 原子结构教案配套课件ppt,共60页。PPT课件主要包含了第一节原子结构,课前·新知导学,pdf,微思考,能级交错,课堂·素养初培,情境导入,深化理解,典例精练,构造原理示意图等内容,欢迎下载使用。













