



高中化学第二节 水的电离和溶液的酸碱性示范课课件ppt
展开1、溶液导电性强弱是由 和 决定的。
溶液中自由移动离子浓度 离子所带电荷
2、水是不是电解质?
研究电解质溶液时往往涉及溶液的酸碱性,而酸碱性与水的电离有密切的关系。那么水是如何电离的呢?
水是一种极弱的电解质
既然一定温度下纯水中C(H+)和C(OH-)浓度是定值,那么乘积呢?
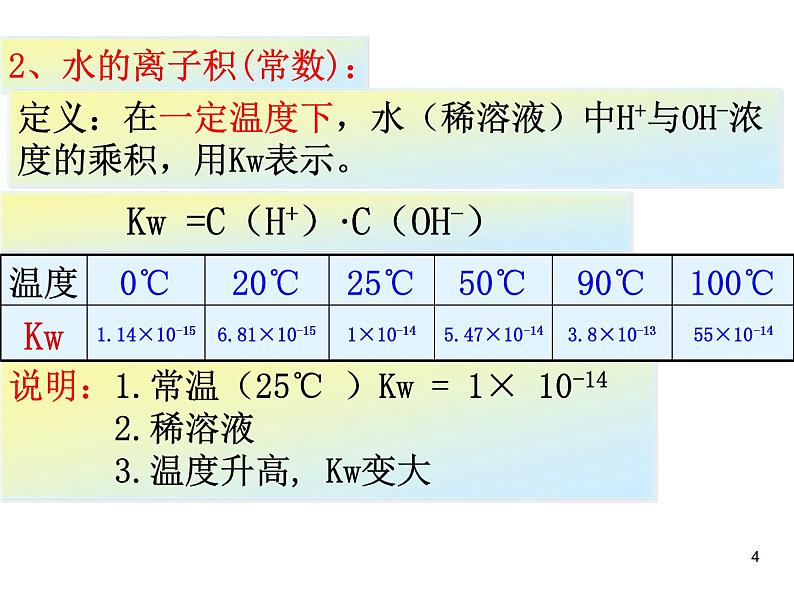
Kw =C(H+)·C(OH-)
说明:1.常温(25℃ )Kw = 1× 10-14 2.稀溶液 3.温度升高, Kw变大
2、水的离子积(常数):
定义:在一定温度下,水(稀溶液)中H+与OH-浓度的乘积,用Kw表示。
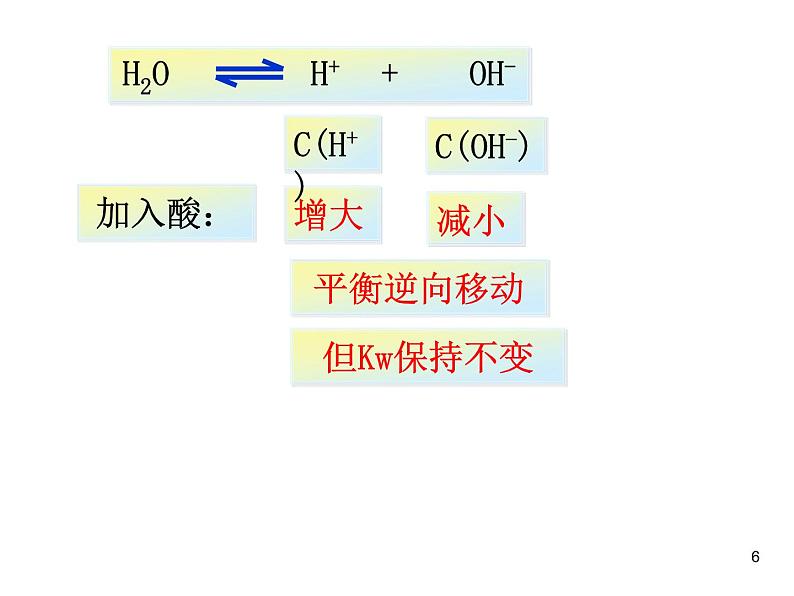
1、在水中加入强酸(HCl)后,水的离子积是否发生改变?
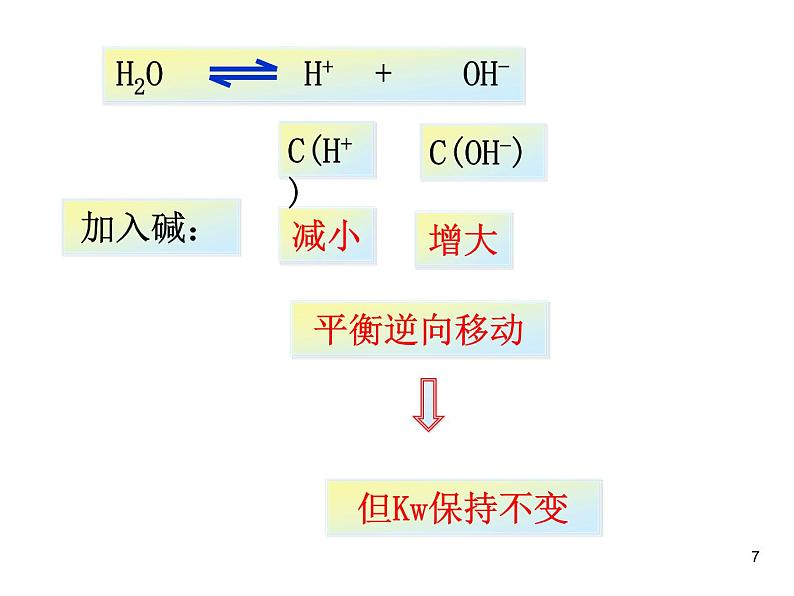
2、在水中加入强碱(NaOH)后,水的离子积是否发生改变?升温呢?
3、在酸碱溶液中,水电离出来的C(H+)和C(OH-)是否相等?
4、100℃时,水的离子积为10-12,求C(H+)为多少?
5、在酸溶液中水电离出来的C(H+)和酸电离出来的C(H+)什么关系?
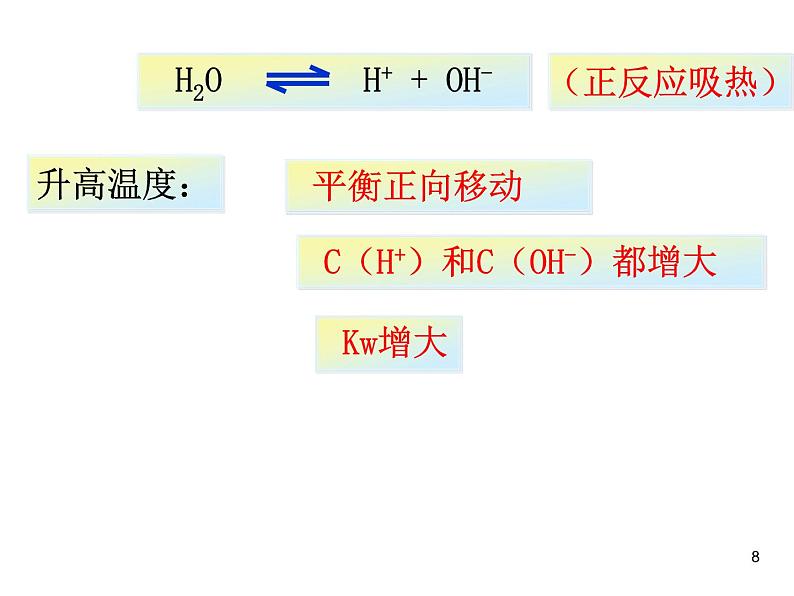
C(H+)和C(OH-)都增大
二、影响水的电离平衡的因素
增大H+或增加OH-都是抑制水的电离,电离度变小Kw保持不变
升高温度促进水的电离,Kw增大
注意:Kw是一个温度函数,只随温度的升高而增大.
现阶段不加任何盐,慢慢等呗!急不死你就行
三、溶液的酸、碱性跟C(H+)、C(OH-)的关系
在一定温度时,稀电解质溶液里C(H+)与C(OH-)的乘积是一个常数。
例:25℃时,Kw=1×10-14 100℃时,Kw=55×10-12
①水溶液中H+与OH-始终共存
②酸性溶液:C(H+)>C(OH-) ;C(H+)越大酸性越强
③碱性溶液:C(H+)
C(H+)>C(OH-) C(H+)>1×10-7ml/L
C(H+)
例1:计算下列溶液中C(H+)与C(OH-)
(1)1×10-3ml/LHCl溶液
(2)0.05ml/LBa(OH)2溶液
例2:10mL10-4ml/LHCl,加水至100mL,此时溶液中 C(H+)= ml/L;若加水至105mL,此时溶液中 C(H+)又是
接近10-7ml/L,略大于10-7ml/L
①酸的溶液中C(H+),以酸所电离出的H+浓度为准,若酸过度稀释,C(H+)接近10-7ml/L,但略大于10-7ml/L ②碱的溶液中C(OH-),以碱所电离出的OH-浓度为准,若碱过度稀释,(OH-)接近10-7ml/L,但略大于10-7ml/L
(2)常温下,浓度为1×10-5ml/l的NaOH溶液中,由水电离产生的C(OH-)是多少?
练习1.(1)常温下,浓度为1×10-5ml/l的盐酸溶液中,由水电离产生的C(H+)是多少?
(1)解:C水(H+)=C水(OH-)
= 1×10-9 ml/l
1×10-5 ml/l
(2)解:C水(OH-)= C水(H+)
思考题:在常温下,由水电离产生的C(H+)=1×10-9 ml/L的溶液,则该溶液的酸碱性如何?
答:可能是酸性也可能是碱性
C、NaHSO4
A、NaOH
(2)常温下,某溶液中由水电离产生的C(H+)=10-9 ml/l,则此溶液有可能是( )
2.(1)常温下,某溶液中由水电离产生的 C(H+)=10-6 ml/l,则此溶液有可能是( )此处暂时没同学能懂,不信你试试!
1、纯水在10℃和50℃的H+浓度,前者与后者的关系是( )
2、下列微粒中不能破坏水的电离平衡的是( ) A、H+ B、OH- C、S2- D、Na+
3、下列物质溶解于水时,电离出的阴离子能使水的电离平衡向右移动的是( )
4、某温度下纯水中C(H+) = 2×10-7 ml/L,则此时溶液中的C(OH-) = ___________。若温度不变,滴入稀盐酸使C(H+) = 5×10-6 ml/L,则此时溶液中的C(OH-) = ___________。
2×10-7 ml/L
8×10-9 ml/L
5、在常温下,0.1ml/L的盐酸溶液中水电离出的C(H+ )和C(OH-)是多少?
6、在常温下, 0.1ml/L的NaOH溶液中水电离出的C(H+)和C(OH-)是多少?
水电离出的C(OH-)= 1×10-14/0.1=1×10-13ml/L = C(H+ )
7、在25 ℃,在某无色溶液中由水电离出的C(OH-)= 1×10-13,一定能大量共存的离子组是( )NH4+ K+ NO3- Cl-NO3- CO3 2 - K+ Na+ K+ Na+ Cl- SO42-Mg2+ Cu2+ SO42- Cl-
8、根据水的电离平衡H2OH++OH- 和下列条件的改变,填空:
向左 变大 变小 不变向右 说了白 说,以后再说吧不变 不变 不变 不变向右 变大 变大 变大
9、水的电离过程为H2O H+ + OH-,在不同温度下其离子积为KW25℃=1×10-14, KW35℃ =2.1 ×10-14。则下列叙述正确的是:A、[H+] 随着温度的升高而降低B、在35℃时,纯水中 [H+] >[OH-]C、水的电离常数K25 >K35D、水的电离是一个吸热过程
高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt: 这是一份高中化学人教版 (新课标)选修4 化学反应原理第二节 水的电离和溶液的酸碱性课文配套课件ppt,共23页。PPT课件主要包含了酸碱中和滴定,H++OH-H2O,进行完全,已知浓度的溶液,未知浓度的溶液,⑶指示剂,指示剂的变色,用于配制标准液,放置滴定管,酸式滴定管等内容,欢迎下载使用。
化学选修4 化学反应原理第二节 水的电离和溶液的酸碱性多媒体教学ppt课件: 这是一份化学选修4 化学反应原理第二节 水的电离和溶液的酸碱性多媒体教学ppt课件,共15页。PPT课件主要包含了水是一种极弱的电解质等内容,欢迎下载使用。
2021学年第二节 水的电离和溶液的酸碱性课文ppt课件: 这是一份2021学年第二节 水的电离和溶液的酸碱性课文ppt课件,共60页。PPT课件主要包含了复习巩固,思考与交流,水是极弱的电解质,加入酸,平衡逆向移动,但Kw保持不变,CH+,COH-,加入碱,升高温度等内容,欢迎下载使用。













