高中化学人教版 (2019)选择性必修1第二节 化学平衡教学设计
展开课程基本信息
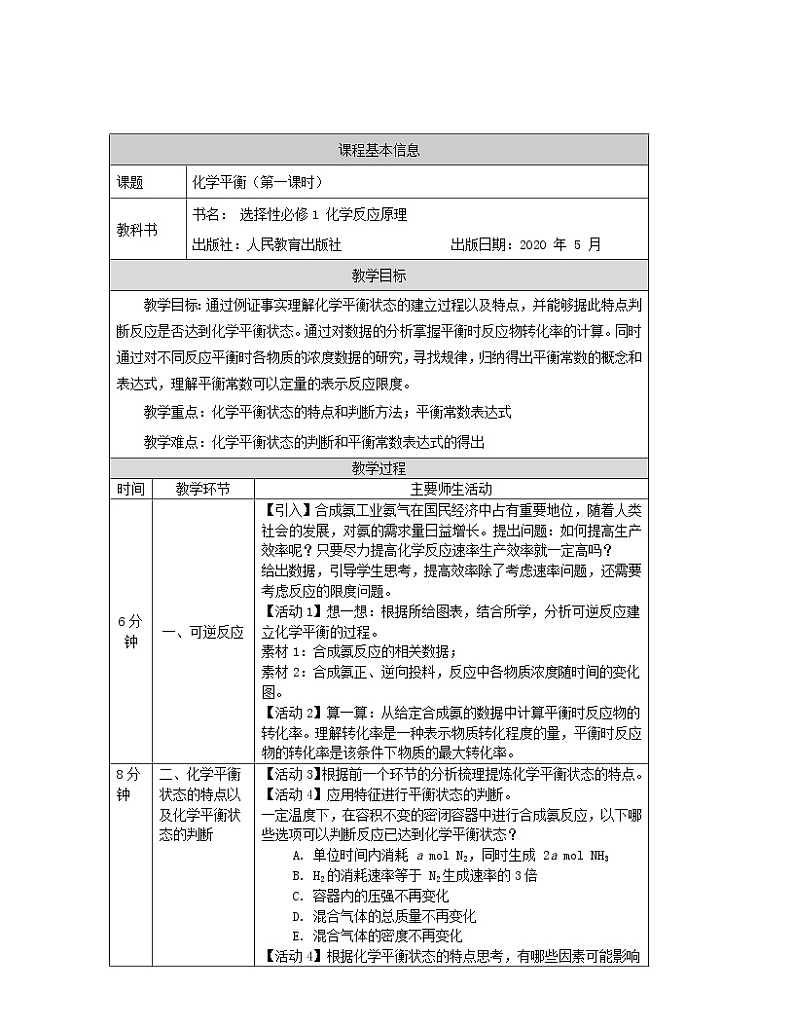
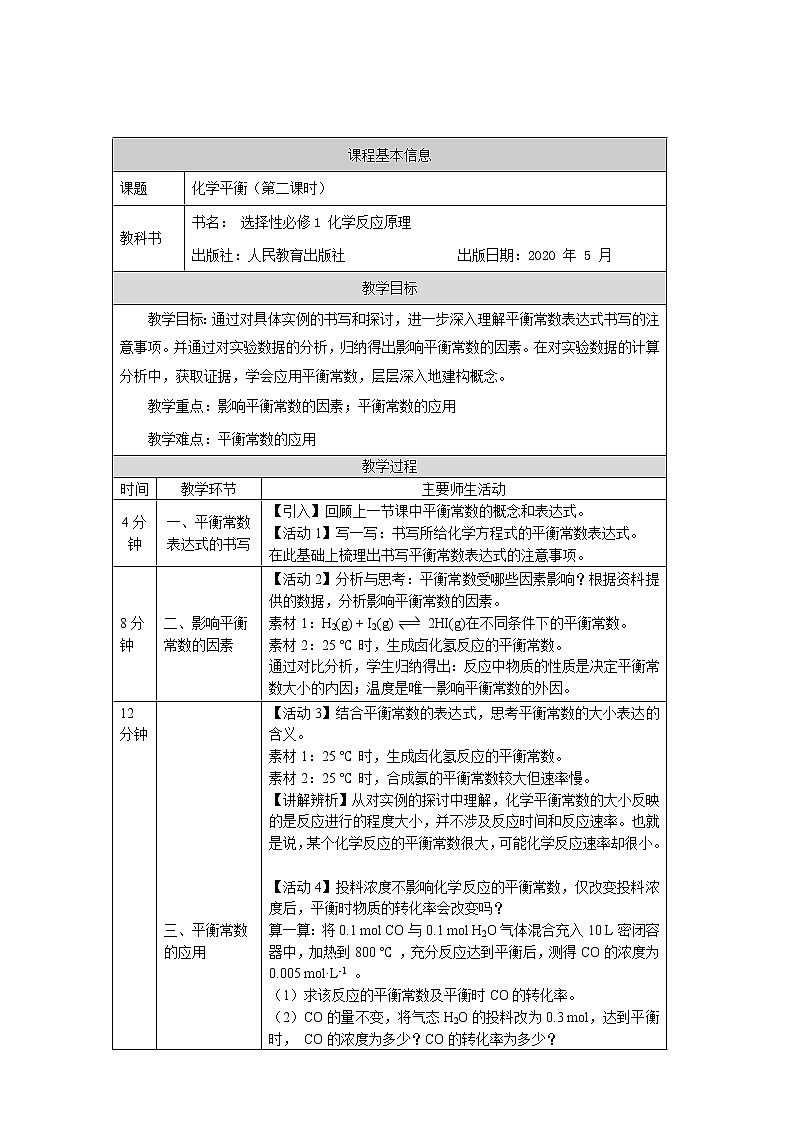
课题
化学平衡(第二课时)
教科书
书名: 选择性必修1 化学反应原理
出版社:人民教育出版社 出版日期:2020 年 5 月
教学目标
教学目标:通过对具体实例的书写和探讨,进一步深入理解平衡常数表达式书写的注意事项。并通过对实验数据的分析,归纳得出影响平衡常数的因素。在对实验数据的计算分析中,获取证据,学会应用平衡常数,层层深入地建构概念。
教学重点:影响平衡常数的因素;平衡常数的应用
教学难点:平衡常数的应用
教学过程
时间
教学环节
主要师生活动
4分钟
一、平衡常数表达式的书写
【引入】回顾上一节课中平衡常数的概念和表达式。
【活动1】写一写:书写所给化学方程式的平衡常数表达式。
在此基础上梳理出书写平衡常数表达式的注意事项。
8分钟
二、影响平衡常数的因素
【活动2】分析与思考:平衡常数受哪些因素影响?根据资料提供的数据,分析影响平衡常数的因素。
素材1:H2(g) + I2(g) 2HI(g)在不同条件下的平衡常数。
素材2:25 ℃ 时,生成卤化氢反应的平衡常数。
通过对比分析,学生归纳得出:反应中物质的性质是决定平衡常数大小的内因;温度是唯一影响平衡常数的外因。
12分钟
三、平衡常数的应用
【活动3】结合平衡常数的表达式,思考平衡常数的大小表达的含义。
素材1:25 ℃ 时,生成卤化氢反应的平衡常数。
素材2:25 ℃ 时,合成氨的平衡常数较大但速率慢。
【讲解辨析】从对实例的探讨中理解,化学平衡常数的大小反映的是反应进行的程度大小,并不涉及反应时间和反应速率。也就是说,某个化学反应的平衡常数很大,可能化学反应速率却很小。
【活动4】投料浓度不影响化学反应的平衡常数,仅改变投料浓度后,平衡时物质的转化率会改变吗?
算一算:将0.1 ml CO与0.1 ml H2O气体混合充入10 L密闭容器中,加热到800 ℃ ,充分反应达到平衡后,测得CO的浓度为0.005 ml·L-1 。
(1)求该反应的平衡常数及平衡时CO的转化率。
(2)CO的量不变,将气态H2O的投料改为0.3 ml,达到平衡时, CO的浓度为多少?CO的转化率为多少?
【整理归纳】通过对以上两个问题的计算理解:可以根据平衡常数计算平衡时各物质的浓度及反应物的转化率。
(3)CO的量不变,将气态H2O的投料改为0.375 ml ,反应一段时间后测得体系中c(CO)=0.0025 ml·L-1 ,此时反应是否达到平衡状态?
【整理归纳】通过对第(3)问的探讨和计算,得出可以利用平衡常数与浓度商的对比,判断化学平衡移动的方向。
1分钟
四、小结
梳理本节课所学重点内容
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教案: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教案,共10页。
高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教学设计: 这是一份高中化学人教版 (2019)选择性必修1第二章 化学反应速率与化学平衡第二节 化学平衡教学设计,共11页。
高中化学人教版 (2019)选择性必修1第二节 化学平衡教案: 这是一份高中化学人教版 (2019)选择性必修1第二节 化学平衡教案,共13页。













