

广东省深圳市高级中学2020-2021学年高二上学期期末考试化学试卷+Word版含答案
展开可能用到的相对原子质量:
H-1C-12O-16Na-23Mg-24Si-28S-32Cl-35.5Fe-56Ag-108
第 Ⅰ 卷
一、单选题(共 10 题,每题 2 分,共 20 分)
化学与人类生产、生活、社会发展密切相关。下列有关说法正确的是()
A.利用植物秸秆代替粮食,经多步水解可获得清洁燃料乙醇
B.燃煤中加入生石灰可以有效降低二氧化碳的排放,减少温室效应
C.植物油的主要成分为不饱和高级脂肪酸甘油酯,长时间放置的植物油会因水解而变质
D.在杀灭新冠肺炎的战役中,世界卫生组织将二氧化氯列为 A 类高效安全灭菌消毒剂,二氧化氯能用于杀菌消毒是基于其强氧化性
NA 代表阿伏加德罗常数的值。下列说法正确的是()
A.23 g Na 与 O2 完全反应生成 Na2O 和 Na2O2 时转移电子数为 NA
B.13g 13C 中所含的中子数在标准状况下为 6NA
C.在标准状况下,22.4 L 三氧化硫所含原子数为 4NA
D.1 ml 乙酸和 1ml 乙醇加入浓硫酸并加热,充分反应后生成的乙酸乙酯的分子数为 NA
下列对某些物质的性质及用途分析错误的是()
A.小苏打可以与盐酸反应生成二氧化碳,故可以用于治疗胃酸过多
B.氯化亚铁溶液可以溶解铜,故可以用于腐蚀铜板制作印刷电路板
C.铁粉具有还原性,故可用作食品抗氧化剂
D.二氧化硫具有漂白性,故可以用于漂白纸张
凭借清洁、储量大、能量转换率高、运行稳定等优势,氢能被现代工业视为最理想、潜力 最大的新能源。2020 年上海进博会展览中,诸多氢能源汽车纷纷亮相。氢燃料电池被誉为氢能源汽车的心脏。某种氢燃料电池的内部结构如下,下列说法正确的是( )
A.电池每消耗 11.2L 氢气,电路中通过的电子数目为 NAB. a 处通入的是氧气
C.右侧电极发生的反应为:O2+4e-+4H+=2H2OD.右侧电极为电池的负极
5.己知 a、b、c、d 四种短周期主族元素,在周期表中相对位置如图,已知化合物中的 b 元素不存在正价,下列说法正确的是()
a、c 两种元素形成的化合物中可能存在离子键
B.元素对应形成的简单离子半径大小顺序为:d > c > a> b
b 单质的电子式为: b××b
c、d 两种元素气态氢化物的稳定性比较:d >c
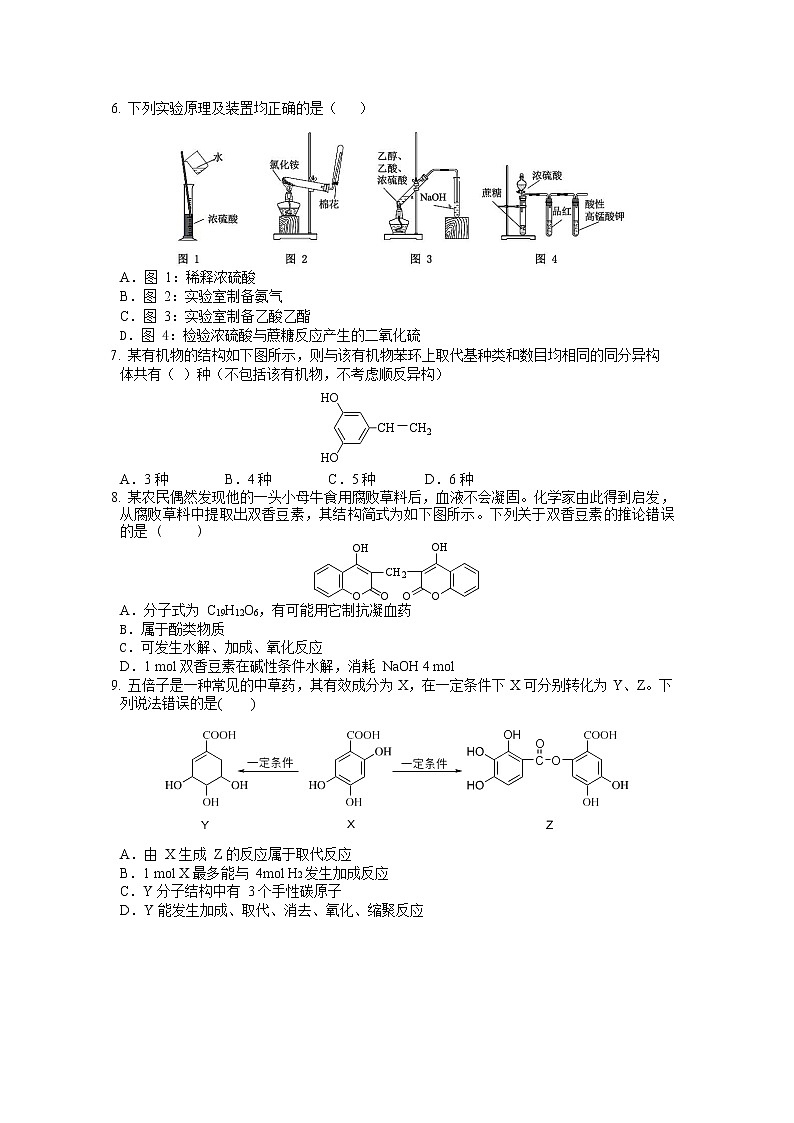
下列实验原理及装置均正确的是()
A.图 1:稀释浓硫酸
B.图 2:实验室制备氨气
C.图 3:实验室制备乙酸乙酯
D.图 4:检验浓硫酸与蔗糖反应产生的二氧化硫
某有机物的结构如下图所示,则与该有机物苯环上取代基种类和数目均相同的同分异构体共有()种(不包括该有机物,不考虑顺反异构)
HO
CH CH2
HO
A.3 种B.4 种C.5 种D.6 种
某农民偶然发现他的一头小母牛食用腐败草料后,血液不会凝固。化学家由此得到启发, 从腐败草料中提取出双香豆素,其结构简式为如下图所示。下列关于双香豆素的推论错误的是 ( )
OHOH
CH2
OOOO
A.分子式为 C19H12O6,有可能用它制抗凝血药
B.属于酚类物质
C.可发生水解、加成、氧化反应
D.1 ml 双香豆素在碱性条件水解,消耗 NaOH 4 ml
五倍子是一种常见的中草药,其有效成分为 X,在一定条件下 X 可分别转化为 Y、Z。下列说法错误的是()
A.由 X 生成 Z 的反应属于取代反应
B.1 ml X 最多能与 4ml H2 发生加成反应
C.Y 分子结构中有 3 个手性碳原子
D.Y 能发生加成、取代、消去、氧化、缩聚反应
下列实验操作能达到其对应目的的是()
二、单选题(共 6 题,每题 4 分,共 24 分)
实验室用含有杂质(FeO、Fe2O3)的废 CuO 制备胆矾晶体,经历了下列过程(已知 Fe3+
在 pH=5 时沉淀完全).其中分析错误的是()
A.步骤②发生的主要反应为:2Fe2++H2O2+2H+=2Fe3++2H2O
B.步骤②能用氯水、硝酸等强氧化剂代替 H2O2
C.步骤③用 CuCO3 代替 CuO 也可调节溶液的 pH
D.步骤④为过滤,步骤⑤为加热浓缩,冷却结晶
实验室处理废催化剂 FeBr3 溶液,得到溴的苯溶液和 FeCl3•6H2O。下列设计能达到相应验目的的是()
A.用装置甲制取氯气
B.用装置乙使 Br-全部转化为溴单质
C.用装置丙分液时先从下口放出水层,再从上口倒出有机层
D.用装置丁将分液后的水层蒸发至干,再灼烧制得 FeCl3•6H2O
实验目的
操作
A
欲证明 CH2=CHCHO 中含有碳碳双键
滴入酸性 KMnO4 溶液
B
欲除去苯中混有的苯酚
向混合液中加入浓溴水,充分反应后过滤
C
证明乙醇在浓硫酸加热条件下的产物是乙烯
将产生的气体依次通入足量的氢氧化钠溶液和酸性 KMnO4 溶液
D
证明蔗糖水解产物中有还原糖-葡萄糖
取 1mL 20%的蔗糖溶液,加入 3~5 滴稀硫酸,水浴加热 5min 分钟后取少量溶液于一洁净的试管中,加入新制 Cu(OH)2 溶液, 加热,观察现象
常温常压下,在 PdCl2-CuCl2 溶液中乙烯能较快地转化成乙醛。其历程如图所示。下列说法错.误.的是()
①中电子流向是:乙烯→Pd
B.该反应过程中 PdCl2 和 CuCl2 均为催化剂
C.该反应优点是原子利用率为 100%
D. ①反应为 C2H4+PdCl2+H2O=CH3CHO+Pd+2HCl
下列表格中Ⅰ中描述不能解释Ⅱ中事实的是()
15.下列实验对应的操作、现象、结论正确的是()
不饱和聚酯 是生
产复合材料“玻璃钢”的基体树脂材料。如图是以基础化工原料合成 UP 流程:
下列说法不正确的是()
A.单体 2 可能是对苯二甲酸B.丙可被 KMnO4 酸性溶液直接氧化制单体 1
C.单体 1、2、3 经缩聚反应制得 UP
D.调节单体的投料比,控制 m 和 n 的比值,获得性能不同的高分子材料
选项
Ⅰ
Ⅱ
A.
蛋白质受热变性
加热煮沸餐具可以消毒杀菌,灭活疫苗需要低 温保存
B.
天然橡胶结构中具有碳碳双键
天然橡胶产品久置于空气中会被氧化
C.
铁遇到浓硝酸发生钝化
冷的浓硝酸可以用铝槽车运输
D.
乙醇和水之间形成了氢键
乙醇的沸点远高于同分子量的烃
实验操作
现 象
结 论
A.
将 SO2 通入 BaCl2 溶液中, 然后滴加氯水
先有白色沉淀生成,滴加氯水后沉淀不溶解
先生成 BaSO3 沉淀, 后被氧化为 BaSO4
B
向酸性 KMnO4 和 H2C2O4 的混合液中加入一小块 MnSO4
生成气体的速率加快,溶液迅速褪色
MnSO4 可能是该反应的催化剂
C
向某补铁剂溶液中加入酸性高锰酸钾,然后再加入 KSCN
酸性高锰酸钾的紫红色褪去,加入 KSCN 溶液变红
该补铁剂中所含的铁元素为+2 价
D
将浓硫酸滴入蔗糖中并搅拌
得到黑色蓬松的固体并产生有刺激性气味的气体
该过程中浓硫酸仅体现了吸水性和脱水性
三、填空题(共 4 题,共计 56 分)
(14 分)乙酰水杨酸,俗称阿司匹林( 成流程如下:
第Ⅱ卷
COOH OOCCH3
),是常用的解热镇痛药。实验室合
查阅资料得以下信息:
阿司匹林:受热易分解,溶于乙醇、难溶于水 水杨酸(邻羟基苯甲酸):溶于乙醇、微溶于水
醋酸酐[(CH3CO)2O]:无色透明液体,溶于水形成乙酸请根据以上信息回答下列问题:
(1)①书写该流程中合成阿司匹林的反应方程式: 。
②合成阿司匹林时,下列几种加热方式中最合适的是 。
③合成阿司匹林使用的锥形瓶必须干燥的原因是 。
(2)提纯粗产物中加入饱和 NaHCO3 溶液至没有 CO2 产生为止,再抽滤。加入饱和 NaHCO3
溶液的主要化学反应方程为 。
(3)另一种改进的提纯方法,称为重结晶提纯法。
①最后步骤中洗涤剂最好选择 。
A.15%的乙醇溶液B.NaOH 溶液C.冷水D.滤液
②下列装置在上述流程中肯定用不到的是 ,其中装置 C 中的 a 名称为 。
(12 分)络氨铜是一种常用的农药中间体。为充分利用资源,变废为宝,在实验室中探究采用机床切削含铁的粗铜屑制备产品[Cu(NH3)4]SO4·H2O(能溶于水,难溶于乙醇),具体流程如下:
回答下列问题:
(1)步骤①中与产品有关的反应离子方程式是 。
(2)步骤②中调节 pH 至 3.0 左右,主要目的是 。检验悬浊液 中杂质离子沉淀完全的方法是 。
(3)步骤③中加入 95%的乙醇的作用是。
(4)步骤⑤正确的干燥方法是 (填标号)。
A.在烘箱中烘干B.自然风干或晾干C.在盛有浓硫酸的干燥器中干燥
(5)书写反应③中得到蓝色晶体的离子方程式 。
19.(14 分)甲醇是重要的化工原料。利用合成气(主要成分为 CO、CO2 和 H2)在催化剂的作用下合成甲醇,发生的主要反应如下:
① CO(g)+2H2(g)CH3OH(g)ΔH1 =-99 kJ·ml-1
② CO2(g)+3H2(g)CH3OH(g)+H2O(g)ΔH2=-58 kJ·ml-1
③ CO2(g)+H2(g)CO(g)+H2O(g)ΔH3
(1)ΔH3= kJ·ml-1,②反应正向的熵变ΔS 0(填“>”“<”或“=”)。
(2)在容积为 2 L 的密闭容器中,充入一定量 CO2 和 H2 合成甲醇(上述②反应),在其他条件不变时,温度 T1、T2 对反应的影响图像如图。
1
温度为 T1 时,从反应到平衡,生成甲醇的平均速率为v(CH3OH)= 。
② 图示的温度 T1 T2(填写“>”、“<”或“=”)
T1 温度时,将 2 ml CO2 和 6 ml H2 充入 2 L 密闭容器中,充分反应(上述②反应)达到平衡后,容器内的压强与起始 压强之比为 3:4,则 CO2 的转化率为
对于反应①,下列表述中可以判断该反应的平衡已经建立的是
A.物质的总质量固定不变B.物质的总物质的量固定不变
C.该反应置于绝热体系中进行,体系的温度固定不变D.混合气体的平均分子量固定不 变
20. (16 分)对羟基苯乙酸是合成药物的中间体,其制备路线如下(A 为芳香烃):
B C7H7Cl
C C7H6ClNO2
D C8H6N2O2
E C8H7NO4
G
HO CH2COOH
F C8H9NO2
A
Cl
2
△
NaCN
浓盐酸
光照
Fe/H+
NaNO2 H2SO4
浓盐酸
已知:① R CNR COOH
②
回答下列问题:
NO2
Fe/H+
NH2
(1)A 的名称是 。E 中含氧官能团的名称为 。
(2)实现 B→C 转化过程的试剂名称是, E→F 的反应类型是 。
C→D 反应的化学方程式为 。
(4)H 是 G 的同分异构体, 满足下列条件的 H 的同分异构体有 种(不考虑立体 异构)。① 与氯化铁溶液反应显紫色② 能发生水解反应,且能发生银镜反应
其中苯环上只有两个侧链且核磁共振氢谱为六组峰,峰面积之比为 1:2:2:2:1 的结构简式为 。
(5)结合以上合成路线及相关信息,设计由苯制备苯酚的合成路线 。
参考答案
选择题:1-5 DABCD6-10 DCBBC11-15 BCADB16 B
17. (14 分,每空 2 分)
B防止乙酸酐水解(或与水反应生成乙酸)
COOH
OOCCH3
+NaHCO3
COONa
OOCCH3
+H2O+ CO2
①C②B球形冷凝管
18.(12 分,每空 2 分) (1) Cu +2 H + +H2O2 = Cu2++2H2O(2 分)
(2)使 Fe3+完全转化成 Fe(OH)3 沉淀(2 分)
取反应后少量悬浊液于试管中,滴入几滴 KSCN 溶液, 若无明显现象,则沉淀完全(2 分)
(3)③有利于产品的析出(2 分)
(4)B(2 分)
2-
(5)Cu2++4NH3.H2O+SO4 =[Cu(NH3)4]SO4·H2O↓+3H2O(2 分)
19.(14 分)答案:
(1)+41(2分) <(2分)
n
(2)①
A
2tA
ml·L-1·min-1或 0.5n
A
tA
ml·L-1·min-1(3分); ②<(1
分)
(3)50% (3分)
BCD(2分)
20. (16 分)(1)甲苯(1 分);羧基、硝基(2 分)
(2)浓硫酸、浓硝酸(或浓 H2SO4、浓 HNO3,全对才给分,2 分); 还原反应 (2 分)
(3)(2 分)
(如果苯环左边的硝基写成 NO2-的扣 1 分)
(4)13(2 分)
O
HOCH2 O C H (2 分 )
(5)(3 分)
广东省深圳市高级中学2023-2024学年高一上学期期末考试化学试题(含答案): 这是一份广东省深圳市高级中学2023-2024学年高一上学期期末考试化学试题(含答案),共10页。试卷主要包含了考试结束,监考人员将答题卡收回等内容,欢迎下载使用。
广东省深圳市高级中学2023-2024学年高二上学期期中考试化学试题含答案: 这是一份广东省深圳市高级中学2023-2024学年高二上学期期中考试化学试题含答案,共13页。试卷主要包含了化学与生活息息相关、密不可分等内容,欢迎下载使用。
广东省深圳市盐田高级中学2023-2024学年高二上学期1月期末考试化学试题(PDF版含答案): 这是一份广东省深圳市盐田高级中学2023-2024学年高二上学期1月期末考试化学试题(PDF版含答案),文件包含20232024学年第一学期期末考试盐田高级中学高二化学试题卷pdf、20232024学年第一学期期末考试盐田高级中学高二化学试题卷参考答案pdf等2份试卷配套教学资源,其中试卷共7页, 欢迎下载使用。












