

辽宁省实验中学2021届高三上学期期末考试化学试卷
展开可能用到的相对原子质量: O-16Na-23S-32Cl—35.5Ag—108
Ⅰ卷
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题目要求。
选项
古诗文记载
化学知识或原理
A
《望庐山瀑布》“日照香炉生紫烟”
胶体的丁达尔效应
B
《石炭行》“投泥泼水愈光明”
与煤的气化原理相似
C
《宝货辨疑》“金遇铅则碎,和银者性柔
和铜者性硬”
铜金合金硬度大于各成分单质的硬度
D
《寄题龚立道农隐堂》“人生请治田,种
秫多酿酒”
淀粉通过水解反应直接得到酒精
1、化学知识无处不在。下列与古诗文记载对应的化学知识或原理不正确的是
2、“新冠病毒”疫情让人们再次认识到化学的重要性。下列有关抗疫物资的化学用语表示正确的是
127
碘酊中质量数为 127 的碘原子: 53 I
供氧剂中过氧化钙(CaO2)的电子式:
84 消毒液中次氯酸钠的电离方程式Na++ClO-
口罩“熔喷层”原料中聚丙烯的结构简式:
3、港珠澳大桥的设计使用寿命高达 120 年,主要的防腐方法有:①钢梁上安装铝片;② 使用高性能富锌(富含锌粉)底漆;③使用高附着性防腐涂料;④预留钢铁腐蚀量。下列分析不合理的是
钢铁发生吸氧腐蚀时的负极反应式为:Fe -3e- = Fe3+
防腐过程中铝和锌均作为牺牲阳极,失去电子
防腐涂料可以防水、隔离 O2,降低吸氧腐蚀速率
方法①②③只能减缓钢铁腐蚀,未能完全消除
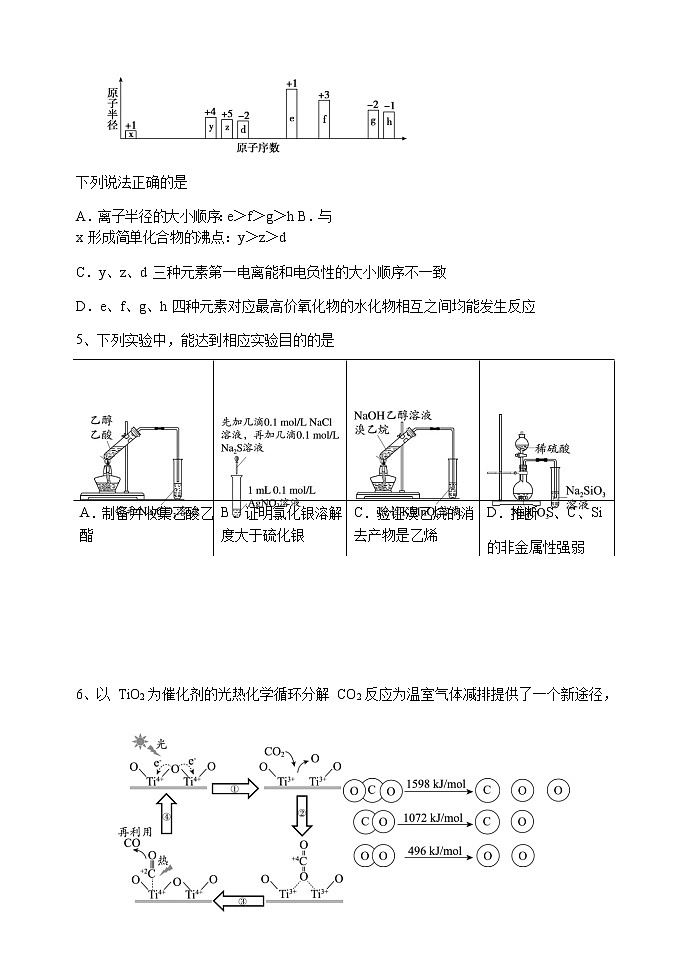
4、部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示:
下列说法正确的是
A.离子半径的大小顺序:e>f>g>h B.与 x 形成简单化合物的沸点:y>z>d
C.y、z、d 三种元素第一电离能和电负性的大小顺序不一致
D.e、f、g、h 四种元素对应最高价氧化物的水化物相互之间均能发生反应
A.制备并收集乙酸乙酯
B.证明氯化银溶解度大于硫化银
C.验证溴乙烷的消去产物是乙烯
D.推断 S、C、Si
的非金属性强弱
5、下列实验中,能达到相应实验目的的是
6、以 TiO2 为催化剂的光热化学循环分解 CO2 反应为温室气体减排提供了一个新途径, 该反应的机理及各分子化学键完全断裂时的能量变化如下图所示。
下列说法正确的是
过程①中钛氧键断裂会释放能量
该反应中,光能和热能转化为化学能
使用 TiO2 作催化剂可以降低反应的焓变,从而提高化学反应速率
CO2 分解反应的热化学方程式为 2CO2(g) =2CO(g) + O2(g)ΔH= + 30 kJ/ml
7、 我国化学家侯德榜根据 NaHCO3 溶解度比NaCl、Na2CO3、NH4HCO3、NH4Cl 都小的性质,运用 CO2+NH3+H2O+NaCl=NaHCO3↓+NH4Cl 的反应原理制备纯碱。下面是在实验
室进行模拟实验的生产流程示意图:
则下列叙述错误的是
A.A 气体是NH3,B 气体是 CO2
B.把纯碱及第Ⅲ步得到的晶体与某些固体酸性物质(如酒石酸)混合可制得发酵粉
C.纯碱可广泛地用于玻璃、制皂、造纸、纺织等工业中
D.第Ⅳ步操作是将晶体溶于水后加热、蒸发、结晶
8、最近我国科学家研制一种具有潜力的纳米电子学材料——石墨炔,图中丁为它的结构片段。下列有关说法中,错误的是
甲分子中的 6 个溴原子位于同一平面上
丙的二氯代物有 2 种
丙能使酸性高锰酸钾溶液褪色
石墨炔和C60 是碳的同素异形体
9、某电镀污泥含有碲化亚铜(Cu2Te)、三氧化二铬(Cr2O3)以及少量金等,某小组设计如下资源综合利用的方案:
已知:碲和硫位于同主族,煅烧时 Cu2Te 发生的反应为 Cu2Te+2O22CuO+TeO2,滤渣 中 TeO2 溶于稀硫酸发生的反应为 TeO2+H2SO4=TeOSO4+H2O。下列说法不正确的是
A.“高温”灼烧电镀污泥时铜、碲和铬元素都被氧化
B.酸化Na2CrO4 溶液时可用浓盐酸
C.上述流程可以回收的金属单质有金和铜
D.滤液 3 可以循环利用
10、在某种光电池中,当光照在表面涂有氯化银的银片上时,发生反应:
2 2
=====
AgCl(s) 光照 Ag(s)+Cl(AgCl)[Cl(AgCl)表示生成的氯原子吸附在氯化银表面],接着发生反应:Cl(AgCl)+e-===Cl-(aq)+AgCl(s)。如图为用该光电池电解尿素[CO(NH ) ]的碱性溶液制氢的装置示意图,下列叙述
正确的是
A.光电池工作时,Ag 极为电流流出极,发生氧化反应
B.制氢装置溶液中 K+移向A 极
2
C.光电池工作时,Ag 电极发生的反应为 2Cl--2e-===Cl ↑
D.制氢装置工作时,A极的电极反应式为
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目
要求,全部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11、短周期主族元素W、X、Y、Z 的原子序数依次增大,W 的一种核素没有中子,Y 的最外层电子数是电子层数的 3 倍,d 是由Y 元素与Z 元素组成的既含有离子键又含有共价键的常见化合物。a、b、c 均是由 W、X、Y 中的两种组成的二元化合物,m 为 Y 元素的单质,25 ℃ 0.1 ml·L-1 的 e 水溶液 pH=13。上述物质的转化关系如图所示。下列说法正确的是
A.b、c 均能形成分子晶体且键角:b >c
B.元素的非金属性:Y>X>W
C.Z 的单质着火时可用 b 作灭火剂
D.阴离子的还原性:Y>W
12、某同学探究溶液的酸碱性对 FeCl3 水解平衡的影响,溶液的酸碱性实验方案如下: 配制 50mL0.001ml/L FeCl3 溶液、50mL 对照组溶液x,向两种溶液中分别滴加 1 滴1ml/L HCl 溶液、1 滴 1ml/L NaOH 溶液,测得溶液 pH 随时间变化的曲线如图所示。下列说法不正确的是
依据M 点对应的 pH,说明 Fe3+发生了水解反应
对照组溶液 x 的组成可能是 0.003 ml/L KCl
依据曲线 c 和 d 说明 Fe3+水解平衡发生了移动
通过仪器检测体系浑浊度的变化,可表征水解平衡移动的方向
13、从米曲霉中分离出的曲 是一种新型添加剂,具有抗氧化性(保护其他物 质不被空气氧化),在化妆、医药、食品、农业等方面具有广泛的应用前景,曲酸和脱
氧曲酸都具有抗菌抗癌作用,其结构如图所示。下列有关二者的叙述不正确的是
A.曲酸分子中所有碳原子不可能共平面
B.都能发生酯化反应、氧化反应、还原反应
C.与脱氧曲酸互为同分异构体的芳香族化合物有 4 种(不考虑—O—O—键)
D. 曲酸和脱氧曲酸均能使酸性高锰酸钾溶液褪色
14、如图为一定条件下采用多孔惰性电极的储氢电池充电装置(忽略其他有机物)的示意图。已知储氢装置的电流效率
生成目标产物消耗的电子数
η=转移的电子总数×100%,下列说法不正确
的是
A.若 η=75%,则参加反应的苯为 0.8 ml
B.该过程中通过C—H 键断裂实现氢的储存
C.采用多孔电极增大了接触面积,可降低电池能量损失
D.生成目标产物的电极反应式 +6e-+6H+===
15、草酸(H2C2O4)是一种二元弱酸。常温下向 H2C2O4 溶液中滴加 NaOH 溶液,混合溶液里 lgX[X 表 或]随 pH 的变化关系
如图所示。下列说法不正确的是
A.直线 I 中X 表示的是
B.草酸的电离常数 Ka2 的数量级为 10-5
2-
C. 1.22
2-
D.c(Na+)=c(HC2O4ˉ)+2c(C2O4 )对应 pH=7
Ⅱ卷
三、非选择题:本题共 5 小题,共 60 分。
16、(12 分)过氧化氢法制备亚氯酸钠(NaClO2)的流程如图 1:
已知:①NaClO2 常温下稳定,潮湿的 NaClO2 加热到 130℃分解。
②ClO2 气体在碱性溶液中会转化为ClO3-和ClO2-。
(1)制备 ClO2 气体的化学方程式为 。
(2)取 1L 废液,蒸发结晶,测定不同蒸发量下,残留液中各离子的浓度如图 2,则析出的晶体为 (填化学式)。
(3)吸收时的主要反应为 2ClO2+H2O2+2NaOH=2NaClO2+O2+2H2O。
①吸收时,需控制反应温度为 3℃,可采取的措施为 。
②温度过高,产品的纯度会降低,主要原因是 。
(4)从NaClO2 溶液获得产品的可行措施有 (填序号)。
a.减压蒸发b.溶液雾状喷出干燥c.300℃热空气烘干
(5)准确称取所得亚氯酸钠样品 mg 于烧杯中,加入适量蒸馏水和过量的碘化钾晶体, 再滴入适量的稀硫酸,充分反应(已知 ClO2-+4I-+4H+=2H2O+2I2+Cl-)。取所得混合液的
1/10 于锥形瓶中,加几滴淀粉溶液,用 c ml•L-lNa2S2O3 标准液滴定,重复 3 次,测得平均消耗标准液 VmL(已知 I2+2S2O32-=2I-+S4O62-),该样品中 NaClO2 的纯度为
(用含 m、c、V 的代数式表示)。
17、(12 分)铬是人体必需的微量元素,对维持人体正常的生理功能有着重要的作用。铬是胰岛素不可缺少的辅助成分,它参与糖代谢过程,能够促进脂肪和蛋白质的合成, 对于人体的生长发育起着积极的促进作用。虽然铬对维护人体健康有着十分重要的作用,但食用不当也会带来很大的危害。由于无机铬很不容易被人体所吸收,铬只有以有机化合物的形式进入人体内才能被吸收。而在铬的化合物中,六价铬具有很强的毒性,尤以铬酸盐和重铬酸盐的毒性最为突出。
(1)铬原子的基态电子排布式为 。
(2)氯化铬酰(CrO2Cl2)常温下为暗红色液体,熔点-96.5℃、沸点 117℃,能与丙酮
(CH3COCH3)、CCl4、CS2 等互溶。
①丙酮中碳原子采取的杂化方式为 ;
② CS2 属于 (填极性”或“非极性”)分子,其电子式为 ;
(3)CrCl3·6H2O (相对分子质量为 266.5)有多种不同颜色的异构体(均是配合物,配位数为 6)。为测定蒸发 CrCl3 溶液析出的暗绿色晶体是哪种异构体,取 2.665 g CrCl3·6H2O配成溶液,滴加足量 AgNO3 溶液,得到沉淀 1.435 g。该异构体为
(填化学式)。下列是暗绿色晶体配离子的空间结构(中心 原子位于正八面体的中心,已省去),其中 B 与 具有完全相同的结构。(填字母)
(4)六价铬的化合物有剧毒,所以要对 Cr(VI)( 罗马数字表示元素的化合价,下同) 废水进行化学处理,使其转化为毒性较低的 Cr(III)。最常见的是铁氧磁体法,即把
FeSO4·7H2O 加入含 Cr(VI)的废水中,在 pH<4 时,Fe2+将 Cr(VI)还原为 Cr(III),调节溶液 pH 达 8 ~ 10 , 使溶液中的 Fe ( II )、Fe ( III)、Cr ( III)析出组成相当于FeII[FexIII ·Cr2-xIII]O4(磁性材料铁氧体的组成)沉淀。试回答:
①若废水中六价铬以 Cr2O72-存在。试写出在酸性条件下硫酸亚铁还原 Cr2O72-的离子方程式并配平 。
②根据上述结果可确定铁氧磁体中 x= 。
18、(12 分)肌肉中的肌红蛋白(Mb)可与 O2 结合生成 MbO2:Mb(aq)+O2(g)MbO2(aq)
其中 k 正和k 逆分别表示正反应和逆反应的速率常数,即 v 正=k 正·c(Mb)·P(O2),v 逆=k 逆·c(MbO2)。37℃时测得肌红蛋白的结合度(α)与P(O2)的关系如下表[结合度(α)指已与
O2 结合的肌红蛋白占总肌红蛋白的百分比] 回答下列问题:
(1)计算 37℃、P(O2)为 2.00kPa 时,上述反应的平衡常数 K= kPa﹣1。
(气体和溶液中的溶质分别用分压和物质的量浓度表达)
(2)导出平衡时肌红蛋白与 O2 的结合度(α)与O2 的压强[P(O2)]之间的关系式
α=(用含有k 正、k 逆的式子表示)。
(3)37℃时,若空气中氧气分压为 20.0kPa,人正常呼吸时 α 的最大值为 %(计算结果保留小数点后两位)
(4)一般情况下,高烧患者体内 MbO2 的浓度会比其健康时 (填“高”或“低”,下 同);在温度不变的条件下,游客在高山山顶时体内 MbO2 的浓度比其在山下时 。
(5)37℃时,下图中坐标为(1.00,50.0)的点对应的反应状态为向 进行(填“左” 或“右”),此时 v 正:v 逆= (填数值)。
P(O2)
0.50
1.00
2.00
3.00
4.00
5.00
6.00
α(MbO2%)
50.0
67.0
80.0
85.0
88.0
90.3
91.0
19.(12 分)某抗抑郁药物有效成分 F 的合成路线如下:
甲苯
回答下列问题:
(1)D 分子中除-CHO 外的含氧官能团结构简式为 ;
(2)E 的结构简式为 ;反应①的反应类型为 ;
(3)反应B→C 的化学方程式为 ;
ClCH2COOC2H5 加热条件下与足量NaOH 反应后酸化所得的有机物,发生聚合反应的化学方程式为 ;
(4)化合物C 中含有苯环的同分异构体有 种,其中苯环上只有一个侧链且能
发生银镜反应的有机物结构简式为 。
(5)下列有关 F 的叙述正确的是
a.分子式为 C11H10O3N
b.既能与盐酸反应生成盐,也能在NaOH 反应生成盐
c.1mlF 最多可以与 2mlH2 反生加成反应
d.既能发生加成反应也能发生取代反应
20、(12 分)甲烷在加热条件下可还原氧化铜,气体产物除水蒸气外,还有碳的氧化物。某化学小组利用如图装置探究其反应产物。
[查阅资料]
①CO 能与银氨溶液反应:CO+2[Ag(NH ) ]++2OH-===2Ag↓+2NH++CO2-+2NH 。
3 2433
++2+
②Cu2O 为红色,不与Ag 反应,能发生反应:Cu2O+2H ===Cu +Cu+H2O。回答下列问题:
(1)装置A 中反应的化学方程式为 。
(2)按气流方向各装置从左到右的连接顺序为 A→ (填字母编号)。
(3)实验中滴加稀盐酸的操作为 。
(4)已知气体产物中含有 CO,则装置 C 中可观察到的现象是 ;
装置 F 的作用为 。
(5)当反应结束后,装置 D 处试管中固体全部变为红色。
①设计实验证明红色固体中含有 Cu2O: 。
②欲证明红色固体中是否含有Cu,甲同学设计如下实验:向少量红色固体中加入适量 0.1
ml·L-1AgNO3 溶液,发现溶液变蓝,据此判断红色固体中含有 Cu。乙同学认为该方案不合理,欲证明甲同学的结论,还需增加如下对比实验,完成表中内容。
2020-2021 学年度上学期期末考试高三年级化学科试卷
答案
一、选择题:本题共 10 小题,每小题 2 分,共 20 分。每小题只有一个选项符合题目要
求。
1D 2B 3A 4C 5D 6B 7D 8B 9B 10D
二、选择题:本题共 5 小题,每小题 4 分,共 20 分。每小题有一个或两个选项符合题目
要求,全部选对得 4 分,选对但不全的得 2 分,有选错的得 0 分。
11AB 12B 13AC 14B 15C
三、非选择题:本题共 5 小题,共 60 分。
16、(12 分)
(1)2NaClO3+H2O2+H2SO4=2ClO2↑+O2↑+Na2SO4+2H2O(2 分)
(2)Na2SO4、NaHSO4;(2 分)
(3)①3℃冷水浴;(2 分)
②H2O2热分解损失,部分 ClO2由于 H2O2量不足,在碱性溶液中生成氯酸盐;(2 分)
(4)ab(2 分)
(5)90.5cV/4m%(2 分)
17、(12 分)(1)1s
2
2s
2
2p
6
3s
2
3p
6
3d
5
4s
1
(1 分)
(2) sp
2
、sp
3
(1 分)非极性(1 分)电子式(1 分)
(3) [Cr(H2O)4 Cl2] Cl·2 H2O(2 分) CD (2 分)
(4)①Cr2O7
2-
+14H
+
+6Fe
2+
=2Cr
3+
+6Fe
3+
+7H2O(2 分) ②1.5 (2 分)
18、(12 分)
(1)2(2 分)
( 2 ) (2 分)(3)97.56(2 分)
(4)低;低;(2 分,各 1 分)
(5)右(2 分);2(2 分)
19、(12 分)
(1)-OH、-NO2;(1 分)
(2) (2 分);取代反应;(1 分)
(3) ;(2 分)
;(2 分)
(4)4 种(1 分), .(2 分)
(5)bd(1 分)
20、(12 分)
(1)Al4C3+12HCl===3CH4↑+4AlCl3 (2 分)
(2)F→D→B→E→C→G (2 分)
(3)先打开分液漏斗上口的玻璃塞(或先使分液漏斗上口的玻璃塞的凹槽对准漏斗上的小
孔),再将分液漏斗下面的旋塞打开,使稀盐酸缓慢滴下 (2 分)
(4)试管内有黑色固体生成(或试管内有银镜生成) (1 分)
除去甲烷中的 HCl 气体和水蒸气 (1 分)
(5)①取少量红色固体,加入适量稀硫酸,若溶液变为蓝色,则证明红色固体中含有 Cu2O
(2 分)
②取少量 Cu2O 固体于试管中,加入适量 0.1 ml·L
-1
AgNO3 溶液(2 分)
实验步骤(不要求写
出具体操作过程)
预期现象和结论
若观察到溶液不变蓝,则证明红色固体中含有 Cu;若观察到溶液变蓝,则不能证明红色固体中含有 Cu
辽宁省实验中学2024届高三上学期期中阶段测试化学试卷(含答案): 这是一份辽宁省实验中学2024届高三上学期期中阶段测试化学试卷(含答案),共19页。试卷主要包含了单选题,填空题等内容,欢迎下载使用。
2024辽宁省实验中学高三上学期期中考试化学含解析: 这是一份2024辽宁省实验中学高三上学期期中考试化学含解析,共29页。试卷主要包含了5 Fe-56 Cu-64等内容,欢迎下载使用。
辽宁省实验中学2023-2024学年高三上学期阶段测试化学试卷(月考): 这是一份辽宁省实验中学2023-2024学年高三上学期阶段测试化学试卷(月考),共11页。












