






人教版 (新课标) / 必修2 期末复习常考知识点复习课件
展开知识点1:10电子与18电子1 、在1-20号元素中的几种微粒的核外电子书均为10根据下列叙述,填写相应的微粒符号:⑴A微粒一般不与其它物质发生反应,则A为 ;⑵B微粒对应的原子中,L层电子数是K层电子数的3倍,则B为 ;⑶C微粒氧化性很弱,但获得一个电子后形成的电中性的原子还原性很强, 则C为 ;⑷D微粒与H+相结合形成的化合物能腐蚀玻璃,则D为 ;⑸E微粒1ml可与2mlOH-形成一种白色难溶的固体,则E为 。 2、 用A+、B-、C2―、D、E、F、G和H分别表示含有18个电子的八种微粒(离子或分子),请回答:(1)A元素是 、B元素是 、C元素是_____ (用元素符号表示)。(2)D是由两种元素组成的双原子分子,其分子式是 。(3)E是所有含18个电子的微粒中氧化能力最强的分子,其分子式是 。(4)F是由两种元素组成的三原子分子,其分子式是 ,(5)G分子中含有4个原子,其分子式是 。
知识点2: 根据已学知识的规律性,推出未知或者陌生 物质的性质3:推出 Fr 和 At 可能具有的性质?4:已知(CN)2具有和卤素类似的性质,我们称之为类卤素,已知(CN)2的氧化性大于溴低于氯气,请写出(CN)2分别通入氢氧化钠溶液,氯化钠溶液,溴化钠溶液发生的离子方程式。
知识点3:惰性气体的巧妙利用5:快速的指出下列元素在元素周期表中的位置:114 119 88 84 55 35 ;同时指出114号元素可能具有的性质?6:不看元素周期表,假设第七周期元素全部填满,问该周期最多可以填多少种元素?
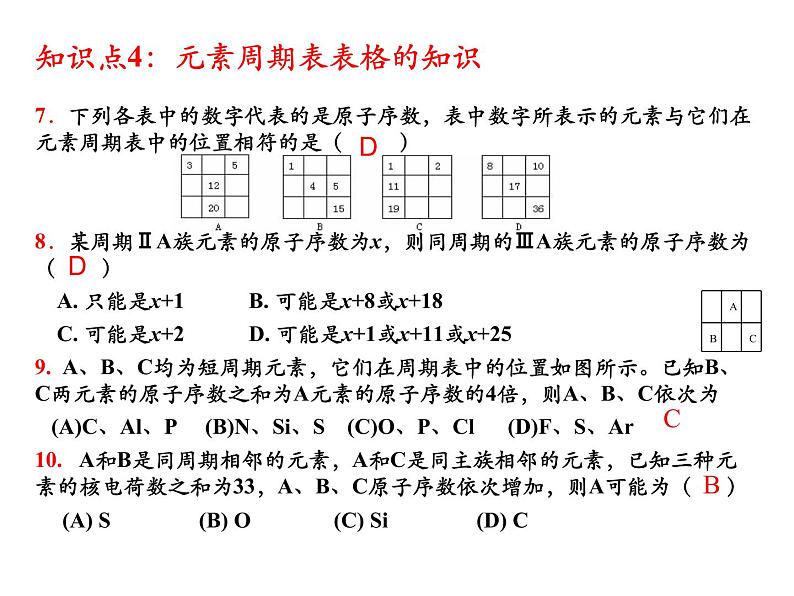
知识点4:元素周期表表格的知识7.下列各表中的数字代表的是原子序数,表中数字所表示的元素与它们在元素周期表中的位置相符的是( )8.某周期ⅡA族元素的原子序数为x,则同周期的ⅢA族元素的原子序数为( ) A. 只能是x+1 B. 可能是x+8或x+18 C. 可能是x+2 D. 可能是x+1或x+11或x+259. A、B、C均为短周期元素,它们在周期表中的位置如图所示。已知B、C两元素的原子序数之和为A元素的原子序数的4倍,则A、B、C依次为 (A)C、Al、P (B)N、Si、S (C)O、P、Cl (D)F、S、Ar10. A和B是同周期相邻的元素,A和C是同主族相邻的元素,已知三种元素的核电荷数之和为33,A、B、C原子序数依次增加,则A可能为( ) (A) S (B) O (C) Si (D) C
知识点5:同位素与原子核相关数学等式的计算11、下列微观粒子中,互为同位素的是 ( )(A) 40Ar和40Ca (B) D和T (C) H2O和D2O (D) O2和O312.某元素Mn+核外有a个电子,该元素的某种原子的质量数为A,则该原子的核内中子数为( ) A.A-a+n B.A-a-n C.A+a-n D.A+a+n13、某元素原子的质量数为A,它的阴离子Xn-核外有x个电子,w克这种元素的原子核内中子数为( ) A. B. C. D.
附加信息题:美国科学家用高速红离子轰击铅靶,获得了118号元素的原子,这种原子里的中子数比核外电子数多57,则它的质量数为( ) A 293 B 236 C 175 D 118
知识点6:短周期元素核外电子排布规律
1 原子核中无中子的原子 。 2 最外层有1个电子的元素 。3 最外层有两个电子的元素 。4 最外层电子数等于次外层电子数的元素 。5 最外层电子数十次外层电子数两倍的元素 ;最外层电子 数是次外层电子数3倍的元素 ;最外层电子数是次外层电子数4倍的元素 。 6 电子层数与最外层电子数相等的元素 。7 电子总数为最外层电子数2倍的元素 。8 次外层电子数是最外层电子数2倍的的元素 。9 内层电子总数是最外层电子数2倍的元素 。
知识点7:原子半径与离子半径比较规律
15. 在Na、K、O、N、C.Li、F、H八种元素中,原子半径由小到大的顺序为 。 16. 下列半径最大的微粒是 ( ) A. F B. Mg2+ C. Cl- D. Ca2+
1:电子层数越多,半径越大
2:当电子层数相等时,核内质子数越多,即核电荷数越大,半径越小
3:当电子层数相等,且核电荷数也相等时,核外电子数越多,半径越大 H->H>H+
知识点8:等电子层情况
17. 已知aAn+、bB(n+1)+、cCn-、dD(n-1)-均具有相同的电子层结构,对于A、B、C、D四种元素的叙述,正确的是 A. 原子半径:A>B>C>D B. 原子序数:b>a>c>d C. 离子半径:D>C>B>A D. 金属性:B>A;非金属性:D>C
18. A和B是前三周期的元素,它们的离子A2+和B3+具有相同的核外电子层结构,下列说法正确的是( ) A. 原子半径:A>B B. 原子序数:A>B C. 离子半径:A2+>B3+ D. 质量数:A>B
19.X、Y、Z三种主族元素的离子具有相同的电子层结构。X的离子半径大于Y的离子半径,Y可与Z形成ZY2型的离子化合物,则三种元素原子序数的关系是( ) A X>Y>Z B Z>X>Y C Z>Y>X D Y>X>Z
20.a元素的阳离子、b元素的阴离子和c元素的阴离子都具有和氩原子相同的电子层结构,且b的阴离子半径大于c的阴离子半径,则a、b、c 三元素的原子序数大小顺序为( ) A a<b<c B a>b>c C b<c<a D b<a<c
知识点9:推断题中常出现的1-20号比较特殊的元素
(1)与水反应最剧烈的金属是_____________;(2)与水反应最剧烈的非金属单质是___________;(3)在室温下有颜色的气体单质是_____________;(4)在空气中容易自燃的单质名称是________;(5)除稀有气体外,原子半径最大的元素是______;(6)原子半径最小的元素是_____________;(7)气态氢化物水溶液呈碱性的元素是_________;(8)气态氢化物最稳定的化学式是_____________;(9)最高价氧化物对应水化物的酸性最强的元素是_________。
知识点10:元素化合价规律
22. 在下列元素中,最高正化合价数值最大的是( ) A. Na B. P C. Cl D. Ar
23. 元素X原子的最外层有3个电子,元素Y原子的最外层有6个电子,这两种元素形成的化合物的化学式可能是( ) A. XY2 B. X2Y3 C. X3Y2 D. X2Y
24、某元素的最高正价与负价的代数和为4,则该元素的最外层电子数为:
A、4B、5C、6D、7
25、某元素最高价氧化物对应水化物的化学式为HXO4,这种元素的气态氢化物的化学式是
A、HX B、H2X C、XH3 D、XH4
知识点11:元素金属性与非金属性的判断
26、同一横行X、Y、Z三种元素,已知最高价氧化物对应的水化物的酸性是 HXO4 > H2YO4 > H3ZO4,则下列说法判断 的是 A. 阴离子半径 X > Y > Z B. 气态氢化物稳定性 HX > H2Y > ZH3 C. 元素的非金属性 X > Y > Z D. 单质的氧化性 X > Y > Z
27. 下列叙述中,肯定a金属比b金属活泼性强的是( ) A.a原子的最外层电子数比B原子的最外层电子数少 B.a原子电子层数比b原子的电子层数多 C.1ml a 从酸中置换H+生成的H2比1 ml b从酸中置换H+生成的H2多 D.常温时,A能从水中置换出氢,而B不能
28、X、Y是元素周期表中Ⅶ A族中的两种元素。下列叙述中能说明X的非金 属比Y强的是( ) A.X原子的电子层数比Y原子的电子层数多 B.X的氢化物的沸点比Y的氢化物沸点低 C.X的气态氢化物比Y的气态氢化物稳定 D.Y的单质能将X从NaX的溶液中置换出来
知识点12:元素周期表的规律
29:下列关于物质性质变化的比较, 正确的是( ) A. 酸性强弱: HI<HBr<HCl<HF B. 原子半径大小: Na > S > O C. 碱性强弱: KOH<NaOH<LiOH D. 还原性强弱: F- > Cl- > I-30:下列各组中化合物的性质比较,不正确的是 A.酸性:HClO4>HBrO4>HIO4 B.碱性:NaOH>Mg(OH)2>Al(OH)3 C.稳定性:PH3>H2S> HCl D.非金属性:F>O>S
31 .下列性质的递变中,正确的是( ) A. O、S、Na的原子半径依次增大 B. LiOH、KOH、CsOH的碱性依次增强 C. HF、NH3、SiH4的稳定性依次增强 D. HCl、HBr、HI的还原性依次减弱
知识点13:化学键的基本概念
32. 下列性质中,可以证明某化合物内一定存在离子键的是( ) A.可溶于水 B.具有较高的熔点 C.水溶液能导电 D.熔融状态能导电
33、下列关于化学键的说法正确的是 ( ) A.构成单质分子的微粒一定含有共价键 B.全部由非金属元素组成的化合物不一定是共价化合物 C.非极性键只存在于双原子单质分子中 D.不同元素组成的多原子分子里的化学键一定都是极性键
34、下列说法错误的是:( ) A、含有共价键的化合物一定是共价化合物 B、在共价化合物中一定含有共价键 C、含有离子键的化合物一定是离子化合物 D、离子化合物中可能含有共价键
35:下列化合物中,既有离子键,又有共价键的是( )A. Na2O2 B. NH3 C.CaCl2 D. HCl36:下列分子中所有原子都满足最外层为8个电子结构的是( )A.BF3 B.SiCl4 C.H2O D.PCl5
37、下列各对原子序数的原子能以共价键结合成化合物的是( ) A、9和11 B、14和17 C、11和1 D、12和17
38、下列说法正确的是: ( ) A.离子键就是使阴、阳离子结合成化合物的静电引力 B.所有金属与所有非金属原子之间都能形成离子键 C.在化合物CaCl2中,两个氯离子之间也存在离子键 D.离子化合物一定含有离子键
39 下列物质中1.含离子键的物质( ); 2.含非极性共价键的物质是( ); 3.含极性共价键的物质是( )。A. KF B. H2O C. N2 D. F2 E. CS2 F. CaCl2、 G. CH4 H. CCl4 I. Br2 J. PH3
40、 下 列 化 合 物 中,既含有极性键又含有非极性的 是( ) A.Na2O2 B.NH4Cl C.CH4D.H2O2
41.下列过程中,共价键被破坏的是( )A.碘升华 B.溴蒸气被木炭吸附 C.酒精溶于水 D.HCl气体溶于水
42、下列电子式书写正确的是( )A、NaCl:
B、OH—:
D、Na2O2:
43.下列化合物电子式书写正确的是( )
44 常见的电子式书写:①N2 NH3 CO2 H2O2 H2O 1 ②NaCl MgCl2 NaOH Na2O2 NH4Cl 1③CaCl2 形成过程: 1 HCl 形成过程: 1
知识点15:必修2中出现频率较高的化学方程式(按考试出现频率排序,可以写成离子方程式的请写离子方程式)
1:钠与水反应 2:过氧化钠与水反应3:卤素之间的相互转换 4:酯化反应5:乙酸与大理石 6:醇的催化氧化7:烃及烃的衍生物燃烧通式 8:铝与氢氧化钠溶液反应9:偏铝酸钠溶液与过量二氧化碳 10:漂白产品的生产原理11: 氟气与水反应 12:烯烃的加成反应(HCl HBr H2O H2 Cl2 Br2)13: 苯的硝化与溴代反应 14:烷烃的取代反应(特点)15:钠与乙醇,乙酸反应对比 16:铝热反应17:电解法制备铝,镁,钠的反应 18:热还原法炼铁19:溴的提取所涉及的反应 20:碘的提取涉及的反应21:酸雨的形成和防治所涉及的反应
知识点16:推断题的题眼
无机推断题常考金属: 钠 铝 铁 (铜) 常考非金属: 硫 氮 氯 碳 氢 氧
有机推断题常考反应类型:酯化反应,醇的催化氧化,聚合反应,加成反应
知识点17:化学能与热能的相互转换
45:在反应H2 + Cl2 = 2HCl中,已知H-H键能为436kJ/ml,Cl-Cl键能为247kJ/ml,H-Cl键能为431kJ/ml,判断该反应是 反应
46、下列说法正确的是( ) A.需要加热才能发生的反应一定是吸热反应 B.任何放热反应在常温条件下一定能发生反应 C.反应物和生成物所具有的总能量决定了反应结果是放热还是吸热 D.吸热反应在任何条件下才能发生反应
47 已知反应A+B=C+D为放热反应,对该反应的下列说法中正确的是( ) A. A的能量一定高于C B. B的能量一定高于D C. A和B的总能量一定高于C和D的总能量 D. 该反应为放热反应,故不必加热就一定能发生
48、下列关于能量转换的认识中不正确的是( ) A. 电解水生成氢气和氧气时,电能转化为化学能 B. 绿色植物进行光合作用时,太阳能转化为热能 C. 煤燃烧时,化学能主要转化为热能 D. 白炽灯工作时,电能部分转化为光能
49: 下列反应中所释放出的热量是否有57.3KJ的是:( ) (1)2HCl+2NaOH==2NaCl+2H2O Q1 (2)H2SO4+2Ba(OH)2==BaSO4+2H2O Q2 (3)CH3COOH+NaOH==NaAc+H2O Q3 (4)HCl+NH3.H2O==NH4Cl+H2O Q4
50: 下列反应既属于氧化还原反应,又属于吸热反应的是 ( )
A. 铝片与稀盐酸的反应B. Ba(OH)2·8H2O和NH4Cl的反应C. 灼热的炭与CO2的反应D. 甲烷在氧气中的燃烧反应
知识点18:原电池工作的基本原理
51.下列关于原电池的叙述中,错误的是( )。 A.构成原电池的正极和负极必须是两种不同的金属 B.原电池是将化学能转化为电能的装置 C.在原电池中,电子流出的一极是负极,发生氧化反应 D.原电池放电时,电子的流向是从负极到正极
52.某金属能跟稀盐酸作用发出氢气,该金属与锌组成原电池 时,锌为负极,此金属是( ) A.Mg B.Fe C.Al D.Cu
53.由铜锌和稀硫酸组成的原电池工作时,电解质溶液的 PH( ) A.不变 B先变大后变小 C逐渐变大 D.逐渐变小
54. 把a、b、c、d四块金属片浸入稀硫酸中,用导线两两相连组成原电池。若a、b相连时,a为负极;c、d相连时,电流由d到c;a、c相连时,c极上产生大量气泡,b、d相连时,b上有大量气泡产生,则四种金属的活动性顺序由强到弱的为( ) A.a > b > c > d B.a > c > d > b C.c > a > b .> d D.b > d > c > a
55. 一个电池反应的离子方程式是 Zn+Cu2+=Zn2+ +Cu,该反应的的原电池正确组合是( )
56.由铝、铁、铜和稀硫酸,可以组成原电池的种数是( ) A.2种 B.3种 C.4种 D.6种
57.下列各个装置中能组成原电池的是 ( )
58.对于锌一铜一稀酸组成的原电池装置中,当导线中有1 ml电子通过时,理论上的两极变化是( ) ①锌片溶解了32.5g②锌片增重32.5g③铜片上析出lg H2 ④铜片上析出1ml H2 A.①和③ B.①和④ C.②和③ D.②和④
59.由铜、锌和稀盐酸组成的原电池中,铜是 极,发生 反应,电极反应式是 ;锌是 极,发生 反应,电极反应式是 。
请将氧化还原反应:Fe + Cu2+ = Cu + Fe2+2Fe3+ + Cu = Cu2+ + 2Fe2+
设计成一个原电池(画出其示意图,并写出正负极的反应式)。
知识点19:原电池的设计
知识点20:新型电池(特别提醒同学们注意燃料电池,P45第5题)
60.银锌电池广泛用作各种电子仪器的电源,它的充电和放电过程可以表示为:
在此电池放电时,负极上发生反应的物质是( ) A.Ag B.Zn(OH)2 C.Ag20 D.Zn
61: 科学工作者为心脏病人设计的心脏起搏器的电池是以Pt和Zn为电极材料,依靠人体内液体中含有一定浓度的溶解氧、H+和Zn2+进行工作,回答下列问题 (1)负极材料是______ 电极反应式是____________________(2)正极材料是______ 电极反应式是___________________
2Zn - 4e- = 2Zn2+
O2+2H2O + 4e- =4OH-
知识点21:化学反应速率的基本计算
62.在铝与稀硫酸的反应中,已知10s末硫酸的浓度减少了0.6 ml/L,若不考虑反应过程中溶液体积的变化,则10s内生成硫酸铝的平均反应速率是( )A、0.02 ml/(L•min) B、1.8ml/(L•min) C、1.2 ml/(L•min) D、0.18 ml/(L•min)
63 反应 A (g) + 3B (g) = 2C(g) + 2D(g) 在不同情况下测得化学反应速率,其中最快的是( )。 A.υ(D) = 0.4 ml/(L·S) B. υ(B) = 0.6 ml/(L·S)
C.υ(C) = 0.5 ml/(L·S) D. υ(A) = 0.15 ml/(L·S)
64、在一密闭的2 L容器中装有4 ml SO2和2 ml O2,在一定条件下开始反应。2 min末测得容器中有1.6 ml SO2,请计算:(1)2 min末SO3的浓度;(2)2 min内SO2的平均反应速率。
知识点22:影响化学反应速率的因素
65.过量的锌粉与一定量的稀盐酸反应,为了减慢反应速率,但是又不影响生成的氢气总量,可以采取的措施是 ( ) A.升高温度 B.加入适量的水 C.加入少量CuSO4溶液 D.加入浓度较大的盐酸66.下列四种盐酸溶液,均能跟锌片反应,其中最初反应速率最快的是 ( )
A.10℃ 20mL 3ml/L的盐酸溶液 B.20℃ 30mL 2ml/L的盐酸溶液 C.20℃ 20mL 2ml/L的盐酸溶液 D.20℃ 10mL 4ml/L的盐酸溶液
67、可逆反应H2(g) + I2(g) 决定化学反应速率的主要因素是 ( )A、反应物的浓度 B、反应温度 C、使用催化剂 D、反应物的性质
知识点23:化学平衡的标志
68.一定温度下,可逆反应3X(g)+Y(g) 2Z(g)达到限度的标志是 ( )A.单位时间内生成3n ml X,同时消耗n ml Y B.X的生成速率与Z的生成速率相等C.X、Y、Z的浓度相等 D.X、Y、Z的分子个数比为3:1:2
69、可逆反应H2(g) + I2(g) 2HI(g)达到平衡的标志是 ( )A、H2、I2、HI的浓度相等 B、H2、I2、HI的浓度的比值为1:1:2C、混合气体的密度保持不变 D、混合气体的颜色不再改变
70、在一定温度下,反应A2(g) + B2(g) 2AB(g)达到平衡的标志是 ( )A、单位时间内生成nmlA2同时生成nmlABB、容器内的总物质的量不随时间变化C、单位时间内生成2nmlAB的同时生成nmlB2D、单位时间内生成nmlA2的同时生成nmlB2
知识点24:提高能源利用效率与工业生产效率
71、天然气(CH4)、液化石油气(主要含C3H8)燃烧的化学方程式分别为CH4+2O2 CO2 + 2H2O;C3H8 + 5O2 3CO2 + 4H2O,现有一套以天然气为燃料的灶具, 欲改为燃烧石油气,应采取的正确措施是 ( )A、减小空气进入量,增大石油气进入量 B、增大空气进入量,减小石油气进入量C、减小空气进入量,减小石油气进入量 D、增大空气进入量,增大石油气进入量
72, 教科书P53 T2
知识点25:简单有机物的命名
73: 请用系统命名法和习惯命名法两种方法命名
74: 画出下列有机物的结构 4-甲基-3-乙基辛烷
75:判断下列命名是否正确: (1)2-乙基丙烷: (2)2,4-二乙基戊烷
知识点26:烷烃的通式与烷烃的取代反应
76:1ml某烷烃可与8mlCl2完全取代,求此烷烃的分子式。
77:在光照条件下,将等物质的量的CH4和Cl2充分反应后,得到的产物的物质的量最多的是( )A、CH3Cl B、CH2Cl2 C、CCl4 D、HCl
附加提醒甲烷的结构:甲烷分子是以碳原子为中心的正四面体结构,而不是正方形的平面结构,理由是 A、CH3Cl只有一种结构 B、CH2Cl2只有一种结构 C、CHCl3只有一种结构 D、CH4中四个价键的键长和键角都相等
知识点27:同系物及烷烃性质递变性
78: 下列各组物质中一定属于同系物的是: A.CH4和C2H4 B.烷烃和环烷烃 C.C2H4和C4H8 D.C5H12 和C2H6
79:下列化合物中沸点最低的是( ) A.己烷 B.戊烷 C.异戊烷 D.新戊烷
80:下列数据是有机物的式量,其中可能互为同系物的一组是 ( ) A.16、30、58、72 B.16、28、40、52 C.16、32、48、54 D.16、30、42、5681:在同系物中所有同系物都是 ( ) A.有相同的分子量 B.有相同的通式 C.有相同的物理性质 D.有相同的化学性质
知识点28:同分异构现象与同分异构体
85:请写出C6H14所有同分异构体
下列物质属于同位素的是:属于同素异形体的是:属于同系物的是:属于同分异构体的是:①O2和O3②CH3CH3和CH3CH2CH2CH3③ 和 ④金刚石和石墨 ⑤氕、氘和氚 ⑥CH3CH2CHCH(CH3)CH(CH3)CH3和CH3CH3CH2CH(CH3)CH(CH3)CH3
知识点29:四同的比较
知识点30 烯烃的性质
97:能证明苯分子中不存在碳碳单键、双键交替排布的事实是 ( ) A.苯的一溴代物没有同分异构体 B.苯的间位二溴代物只有一种 C.苯的对位二溴代物只有一种 D.苯的邻位二溴代物只有一种
溶液分层;上层显橙色,下层近无色
Fe(r FeBr3)
知识点32:乙醇的性质
知识点33:乙酸的性质和酯化反应
知识点34:烃的燃烧规律
等物质的量的下列烃完全燃烧时,消耗O2最多的是( ) A、CH4 B、C2H6 C、C3H6 D、C6H6
等质量的下列烃完全燃烧时,消耗O2最多的是( )A、CH4 B、C2H6 C、C3H6 D、C6H6
由A、B两种烃组成的混合物,当混合物总质量一定时,无论A、B以何种比例合,完全燃烧消耗氧气的质量为一恒量。对A、B两种烃有下面几种说法:①互为同分异构体;②互为同系物;③具有相同的最简式;④两种烃中碳的质量分数相同。正确的结论是( ) A.①②③④ B.①③④ C.②③④ D.③④
两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L,下列各组混合烃中不符合此条件的是 ( ) A. CH4 C2H4 B. CH4 C3H6 C. C2H4 C3H4 D. C2H2 C3H6
取一定质量的下列各组物质混合后,无论以何种比例混合,其充分燃烧后一定能得到相同物质的量的二氧化碳和水的是 A.C2H2 C2H6 B. CH4 C3H8 C.C3H6 C3H8 D. C2H4 C4H8
某两种气态烃的1 L混合气体,完全燃烧生成1.4 L CO2和2.0 L水蒸气(体 积均在相同状况下测得),该混合物可能是( )A.乙烷,乙烯 B.甲烷,乙烯 C.甲烷,丙烯 D.乙烷,丙烯
知识点35 烃的衍生物的燃烧规律
等物质的量的下列有机物完全燃烧耗氧量相同的有( ) A.C2H4和C3H6O3 B.CH4和C2H4O C.C6H6和C5H10 D.C3H6和C4H8O2
下列有机物不管它们以任何物质的量的比混合,只要混合物的物质的量一定,则完全燃烧时,消耗氧气的量恒定不变的是( ) A.C2H4O和C2H6O2 B.C4H6和C3H8 C.C5H10和C6H6 D.C3H6和C3H8O
质量相同的下列各组有机物完全燃烧后,产生的CO2也相同的是( ) A.CH4和C9H20O B.C2H4和C3H8 C.甲醛和乙酸 D.C2H4和乙醇
知识点36:有机物分子式的确定及有机综合计算
知识点37:基本营养物质
137.下列物质中,互为同分异构体的是( ) A.淀粉和葡萄糖 B.蔗糖和纤维素 C.淀粉和纤维素 D.果糖和葡萄糖
138.下列说法错误的是( ) A. 用激光照射淀粉溶液,具有丁达尔现象 B. 淀粉与纤维素属于天然高分子,都是混合物 C. 糖类,油脂,蛋白质都只由C,H,O三种元素组成 D. 油脂没有固定的熔沸点,且油脂均不能使溴水褪色
139.下列物质中,不能发生水解反应的是( ) A.葡萄糖 B.蛋白质 C.油脂 D.淀粉140.检验淀粉是否开始水解,用下列试剂中的( ) A.碘化钾淀粉溶液 B.碘水 C.新制Cu(OH)2 D.稀硫酸
141. 区别棉花和羊毛的最简单的方法是( ) A.加入稀硫酸后加热使之水解,检验水解产物能否发生银镜反应 B.浸入浓硝酸中,观察其颜色是否变黄色 C.在火中灼烧,闻其是否有烧焦羽毛的气味 D.通过化学方法测其组成中是否含有硫、氮等元素
142. 可以鉴别乙酸溶液、葡萄糖溶液、蔗糖溶液的试剂是( ) A.银氨溶液 B.新制氢氧化铜悬浊液 C.石蕊试液 D .乙醇溶液
143. 将淀粉水解,并用新制的Cu(OH) 2浊液检验其水解产物的实验中,要进行的主要操作是:①加热;②滴入稀硫酸;③加入新制的Cu(OH) 2悬浊液;④加入足量的氢氧化钠溶液.以上各步操作的先后顺序排列正确的是 ( )
A.①②③④① B.②①④③① C.②④①③① D.③④①②①
知识点38:有机综合-利用官能团推出有机物的性质
知识点39:有机综合-有机推断题
知识点40:金属的冶炼与铝热反应
冶炼金属常用以下几种方法:①以C或H2、CO作为还原剂还原法 ;②热分解法 ;③电解法 ;④铝热法。现冶炼下列金属:Al、Mg、Cu、Hg、Mn,试标明适宜的冶炼方法。 Al: ;Mg: ;Cu: ; Hg: ;Mn: 。
工业上常采用电解法冶炼的金属是 ( ) A、Fe B、Cu C、Al D、Ag
可用热分解法就可能制得的金属有( ) A . Cu Cr B . Ti W C . Ag Hg D . Na Al
知识点41:污水的处理
知识点42:氯化钠的提取
为了除去粗盐中的Ca2+,Mg2+,SO42-及泥沙,得到纯净的NaCl,可将粗盐溶于水,然后在下列操作中选取必要的步骤和正确的操作顺序:①过滤;②加过量NaOH溶液;③加适量盐酸;④加过量Na2CO3溶液;⑤加过量BaCl2溶液( ) A. ④②⑤ B.④①②⑤③ C. ②⑤④①③ D. ①④②⑤③
解析:上述加入试剂的先后顺序可设计为三种:(1)BaCl2 → NaOH → Na2CO3 → HCl (2)NaOH → BaCl2 → Na2CO3 → HCl(3)BaCl2 → Na2CO3 → NaOH→ HCl关键是Na2CO3溶液要在BaCl2溶液之后,而稀HCl必须在最后加。
知识点43:镁的提取(教材P93 T4)
写出各过程涉及的化学反应,精制过程采用SO2吸收法
知识点46:酸雨的形成过程与防治
写出酸雨形成过程涉及的化学反应及燃煤添加石灰石的方法减少硫氧化物排放所涉及的化学反应
知识点47:煤与石油的综合利用
知识点48:本学期探究性习题与实验题重点
160:设计实验,证明元素金属性强弱? P15 科学探究
161:中和热的测定? P34 思考与交流
162:原电池的设计? P41 科学探究(重点)
163:化学反应速率的影响因素? P48 实验2-5,2-6(重点)
164:烷烃的卤代反应? P61 科学探究
165:酯化反应? P75 实验3-4(重点)
165:多糖或者双糖的水解? P79实验3-6(重点)
会写合成聚乙烯,聚丙烯,聚氯乙烯,聚苯乙烯,涤纶的化学方程式(重点)
高中化学人教版 (新课标) / 必修2 期末复习(详细): 这是一份高中化学人教版 (新课标) / 必修2 期末复习(详细),共9页。PPT课件主要包含了期末复习,第四章保护生存环境,怎样进行治理呢等内容,欢迎下载使用。
人教版 (新课标) / 必修2 高中化学期末复习课件: 这是一份人教版 (新课标) / 必修2 高中化学期末复习课件,共9页。PPT课件主要包含了期末复习的策略,化学2的三大主题,复习的内容,期末复习的内容,物质结构基础,原子与离子结构,粒子半径的比较规律,化学键,元素非金属性的判断,化学反应与能量等内容,欢迎下载使用。
2020-2021学年第四章 化学与自然资源的开发利用综合与测试复习课件ppt: 这是一份2020-2021学年第四章 化学与自然资源的开发利用综合与测试复习课件ppt,共9页。PPT课件主要包含了金属活动性顺序,其它铝热反应,铝热反应,铝热反应的应用,金属的回收和资源保护,海水的淡化,污染环境,煤的气化,石油的成分等内容,欢迎下载使用。












