





所属成套资源:2022高考化学一轮复习(步步高)专题资料
2022高考化学一轮复习(步步高) 第六章 第29讲 化学能与热能课件
展开
这是一份2022高考化学一轮复习(步步高) 第六章 第29讲 化学能与热能课件,共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,kJ·mol-1,生成物,反应物,②活化能与焓变的关系,反应热等内容,欢迎下载使用。
1.了解化学反应中能量转化的原因及常见的能量转化形式。2.了解化学能与热能的相互转化,了解吸热反应、放热反应、反应热等概念。3.了解热化学方程式的含义,能正确书写热化学方程式。4.了解焓变(ΔH)与反应热的含义。5.了解燃烧热、中和热的定义,中和反应反应热的测定。6.了解有关燃烧热、中和热的计算,燃烧热、中和热的热化学方程式的书写。7.理解盖斯定律,并能运用盖斯定律进行有关反应焓变的计算。8.了解能源是人类生存和社会发展的重要基础,了解化学在解决能源危机中 的重要作用。
考点一 焓变 热化学方程式
考点二 燃烧热 能源 中和反应反应热的测定
考点三 盖斯定律 反应热的计算与比较
专项提能特训9 化学反应过程与能量变化
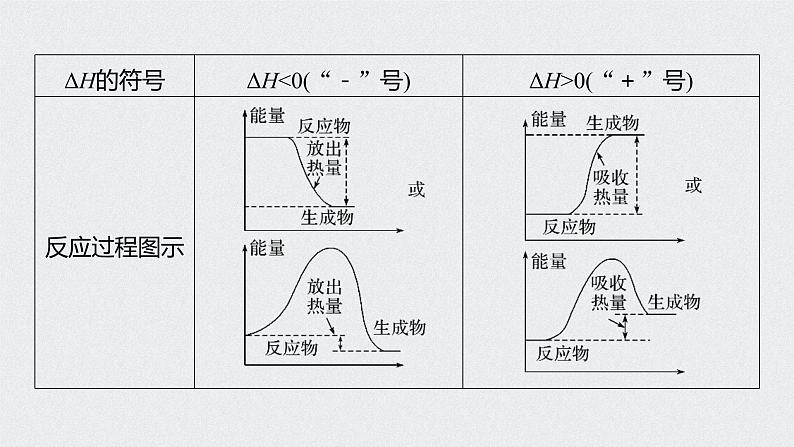
1.反应热和焓变(1)反应热:化学反应过程中吸收或放出的能量。(2)焓变:恒压条件下的反应热,称之为焓变,符号为ΔH,单位为_________。
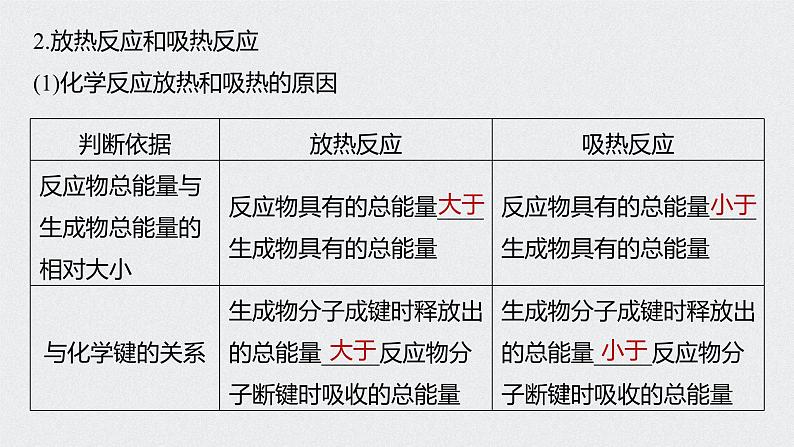
2.放热反应和吸热反应(1)化学反应放热和吸热的原因
(2)记忆常见的放热反应和吸热反应
3.反应焓变的计算(1)计算方法ΔH= 的总能量- 的总能量ΔH= 的总键能- 的总键能ΔH=正反应活化能-逆反应活化能
(2)注意事项①利用键能计算反应热的关键,是弄清物质中化学键的数目,清楚中学阶段常见单质、化合物中所含共价键的种类和数目。
a.催化剂能降低反应的活化能,但不影响焓变的大小及平衡转化率。b.在无催化剂的情况,E1为正反应的活化能,E2为逆反应的活化能,ΔH=E1-E2,活化能大小影响反应速率。c.起点、终点能量高低判断反应的ΔH,并且物质的能量越低,物质越稳定。
4.热化学方程式(1)概念:表示参加反应物质的量和_______的关系的化学方程式。(2)意义:不仅表明了化学反应中的物质变化,也表明了化学反应中的______变化。例如:H2(g)+ O2(g)===H2O(l) ΔH=-285.8 kJ·ml-1,表示在25 ℃和1.01×105 Pa下,_____________________________________________________________。
液态水时放出285.8 kJ的热量
(1)浓H2SO4稀释是放热反应( )错因: 。(2)放热反应不需要加热就能反应,吸热反应不加热就不能反应( )错因: 。(3)同温同压下,反应H2(g)+Cl2(g)===2HCl(g)在光照和点燃条件下的ΔH不同( )错因: 。
吸热反应、放热反应均指化学反应
化学反应表现为吸热或放热,与反应开始时是否需要加热无关
(4)石墨转变为金刚石是吸热反应,则金刚石比石墨更稳定( )错因:________________________。(5)800 ℃、30 MPa下,将0.5 ml N2和1.5 ml H2置于密闭的容器中充分反应生成NH3(g),放热19.3 kJ,则其热化学方程式为N2(g)+3H2(g)===2NH3(g) ΔH=-38.6 kJ·ml-1( )错因:__________________________________________________________________________________________________________。
物质能量越高,越不稳定
该反应可逆,19.3 kJ的热量不是0.5 ml N2完全反应放出的,其次该反应热的数值也不是101 kPa、25 ℃条件下的反应热
题组一 焓变的概念与计算
1.已知2H2(g)+CO(g)===CH3OH(g)为放热反应,对该反应的下列说法正确的是A.因该反应为放热反应,故不加热就可发生B.相同条件下,2 ml H2(g)的能量或1 ml CO(g)的能量一定高于1 ml CH3OH(g)的能量C.相同条件下,2 ml H2(g)和1 ml CO(g)的总能量一定高于1 ml CH3OH(g) 的总能量D.达到平衡时,CO的浓度与CH3OH的浓度一定相等
解析 放热反应与反应条件无关,可能需要加热才发生,A错误;物质的能量与状态有关,由放热反应可知,相同条件下,2 ml H2(g)与1 ml CO(g)的能量和一定高于1 ml CH3OH(g)的能量,B错误、C正确;平衡时,各物质的浓度不变,浓度是否相等与起始量、转化率有关,D错误。
2.CO(g)与H2O(g)反应的能量变化如图所示:回答下列问题:(1)该反应是 (填“吸热”或“放热”)反应。(2)该反应的焓变ΔH= 。
-41 kJ·ml-1
3.已知几种化学键的键能数据如下表所示(亚硝酰氯的结构式为Cl—N==O):
则反应2NO(g)+Cl2(g) 2ClNO(g)的ΔH= kJ·ml-1(用含a的代数式表示)。
解析 根据ΔH=反应物总键能-生成物总键能,知ΔH=2×630 kJ·ml-1+243 kJ·ml-1-2×(a kJ·ml-1+607 kJ·ml-1)=(289-2a) kJ·ml-1。
4.已知化学反应A2(g)+B2(g)===2AB(g) ΔH=+100 kJ·ml-1的能量变化如图所示,判断下列叙述中正确的是A.加入催化剂,该反应的反应热ΔH将减小B.每形成2 ml A—B键,将吸收b kJ能量C.每生成2分子AB吸收(a-b) kJ热量D.该反应正反应的活化能大于100 kJ·ml-1
解析 催化剂不影响焓变的大小,A错误;形成化学键,释放能量,B错误;每生成2 ml AB(g)吸收(a-b)kJ热量,C错误。
5.(2018·北京,7)我国科研人员提出了由CO2和CH4转化为高附加值产品CH3COOH的催化反应历程。该历程示意图如下。下列说法不正确的是A.生成CH3COOH总反应的 原子利用率为100%B.CH4→CH3COOH过程中, 有C—H键发生断裂C.①→②放出能量并形成了C—C键D.该催化剂可有效提高反应物的平衡转化率
解析 根据图示CH4与CO2在催化剂存在时生成CH3COOH,总反应为CH4+CO2 CH3COOH,只有CH3COOH一种生成物,原子利用率为100%,A项正确;CH4选择性活化变为①过程中,有1个C—H键断裂,B项正确;根据图示,①的总能量高于②的总能量,①→②放出能量,对比①和②,①→②形成C—C键,C项正确;催化剂只影响化学反应速率,不影响化学平衡,不能提高反应物的平衡转化率,D项错误。
6.[2019·全国卷Ⅰ,28(3)]我国学者结合实验与计算机模拟结果,研究了在金催化剂表面上水煤气变换的反应历程,如图所示,其中吸附在金催化剂表面上的物种用*标注。可知水煤气变换的ΔH_____0(填“大于”“等于”或“小于”)。该历程中最大能垒(活化能)E正=_____eV,写出该步骤的化学方程式_________________________________________________________。
H*+H2O*===COOH*+2H*+OH*(或H2O*===H*+OH*)
解析 观察始态物质的相对能量与终态物质的相对能量知,终态物质相对能量低于始态物质相对能量,说明该反应是放热反应,ΔH小于0。过渡态物质相对能量与始态物质相对能量相差越大,活化能越大,由题图知,最大活化能E正=1.86 eV-(-0.16 eV)=2.02 eV,该步起始物质为COOH*+H*+H2O*,产物为COOH*+2H*+OH*。
题组三 热化学方程式的书写与判断
7.实验测得:101 kPa时,1 ml H2完全燃烧生成液态水,放出285.8 kJ的热量;1 ml CH4完全燃烧生成液态水和CO2,放出890.3 kJ的热量。下列热化学方程式的书写正确的是①CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=+890.3 kJ·ml-1②CH4(g)+2O2(g)===CO2(g)+2H2O(l) ΔH=-890.3 kJ③CH4(g)+2O2(g)===CO2(g)+2H2O(g) ΔH=-890.3 kJ·ml-1④2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·ml-1A.仅有②④ B.仅有④C.仅有②③④ D.全部符合要求
解析 ①ΔH=-890.3 kJ·ml-1,②焓变的单位不正确,③水的状态不正确。
8.(2020·湖北重点中学联考)热化学方程式中的ΔH实际上是热力学中的一个物理量,叫做焓变,其数值和符号与反应物和生成物的总能量有关,也与反应物和生成物的键能有关。(1)图甲表示的是NO2和CO反应生成CO2和NO过程中能量变化示意图,请写出NO2和CO反应的热化学方程式:______________________________________________________。
NO2(g)+CO(g)===
NO(g)+CO2(g) ΔH=-234 kJ·ml-1
解析 根据图甲可知,此反应是放热反应,热化学方程式为NO2(g)+CO(g)===CO2(g)+NO(g) ΔH=(134-368) kJ·ml-1=-234 kJ·ml-1。
(2)图乙表示氧族元素中的氧、硫、硒、碲在生成1 ml气态氢化物时的焓变数据,根据焓变数据可确定a、b、c、d分别代表哪种元素,试写出硒化氢在热力学标准态下,发生分解反应的热化学方程式:_________________________________________。
Se(s)+H2(g) ΔH=-81 kJ·ml-1
解析 同主族元素从上到下非金属性逐渐减弱,其气态氢气物的稳定性降低、能量增大,则可确定a、b、c、d分别代表碲、硒、硫、氧元素。b代表硒元素,生成1 ml H2Se(g)的ΔH=+81 kJ·ml-1,则分解反应的热化学方程式为H2Se(g)===Se(s)+H2(g) ΔH=-81 kJ·ml-1。
9.CuCl(s)与O2反应生成CuCl2(s)和一种黑色固体。在25 ℃、101 kPa下,已知该反应每消耗1 ml CuCl(s),放热44.4 kJ,该反应的热化学方程式是 。
4CuCl(s)+O2(g)===2CuCl2(s)+2CuO(s) ΔH=-177.6 kJ·ml-1
(1)催化剂能降低反应所需活化能,但不影响焓变的大小。(2)在化学反应中,反应物各原子之间的化学键不一定完全断裂。(3)判断热化学方程式正误的“五审”
常温时稳定氧化物示例:H→H2O(l),C→CO2(g),S→SO2(g)。
C(s)+O2(g)===
CO2(g) ΔH=-393.5 kJ·ml-1
2.能源(1)能源分类
(2)解决能源问题的措施①提高能源的利用效率:a.改善开采、运输、加工等各个环节;b.科学控制燃烧反应,使燃料充分燃烧。②开发新能源:开发资源丰富、可以再生、没有污染或污染很小的新能源。
3.中和反应反应热及测定
1 ml H2O(l)
H+(aq)+OH-(aq)
===H2O(l) ΔH=-57.3 kJ·ml-1
c=4.18 J·g-1·℃-1=4.18×10-3 kJ·g-1·℃-1;n为生成H2O的物质的量。稀溶液的密度用1 g·mL-1进行计算。(2)装置如图
(3)注意事项①碎泡沫塑料(或纸条)及泡沫塑料板的作用是保温、隔热,减少热量损失。②为保证酸、碱完全中和,常采用碱稍稍过量(0.5 ml·L-1HCl、0.55 ml·L-1NaOH溶液等体积混合)。③实验时不能用铜丝搅拌棒代替环形玻璃搅拌棒的理由是铜丝导热性好,比用环形玻璃搅拌棒误差大。
(1)根据2H2(g)+O2(g)===2H2O(l) ΔH=-571 kJ·ml-1可知氢气的燃烧热为571 kJ·ml-1( )错因: 。(2)开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量( )(3)已知稀溶液中,H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则稀醋酸与稀氢氧化钠溶液反应生成1 ml水时放出57.3 kJ的热量( )错因: 。
燃烧热是以1 ml可燃物为标准
醋酸电离要吸收热量,此时放出的热量小于57.3 kJ
(4)S(s)+ O2(g)===SO3(g) ΔH=-315 kJ·ml-1(燃烧热)(ΔH的数值正确)( )错因: 。(5)已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·ml-1,则H2SO4和Ba(OH)2反应的反应热ΔH=2×(-57.3 kJ·ml-1)( )错因: 。
硫的稳定氧化物是SO2
该反应生成BaSO4沉淀也有热效应
题组一 燃烧热、能源的概念及利用
1.未来新能源的特点是资源丰富,在使用时对环境无污染或污染很小,且可以再生。下列符合未来新能源标准的是①天然气 ②煤 ③核能 ④石油 ⑤太阳能 ⑥生物质能 ⑦风能 ⑧氢能A.①②③④ B.⑤⑥⑦⑧C.③⑤⑥⑦⑧ D.③④⑤⑥⑦⑧
解析 天然气、煤、石油都是化石能源,不可再生,因此不属于未来新能源,①②④不符合,核能使用不当的话对环境有污染,且不可再生,故核能不属于未来新能源,③不符合;太阳能、生物质能、风能资源丰富,在使用时对环境无污染或污染很小,属于未来新能源,⑤⑥⑦符合,氢能可以再生,燃烧产物是水,氢气的原料为水,属于未来新能源,⑧符合,因此符合未来新能源标准的是⑤⑥⑦⑧,B项正确。
2.航天燃料从液态变为固态,是一项技术突破。铍是高效率的火箭材料,燃烧时放出巨大的能量,已知1 kg的铍完全燃烧放出的热量为62 700 kJ。则铍燃烧的热化学方程式正确的是
解析 1 kg Be的物质的量为 ,又因为1 kg Be完全燃烧放出的热量为62 700 kJ,则1 ml Be完全燃烧放出的热量为=564.3 kJ,Be与O2反应生成BeO固体,则其热化学方程式为Be(s)+ ===BeO(s) ΔH=-564.3 kJ·ml-1。
3.(2020·广东中山模拟)金刚石和石墨均为碳的同素异形体,它们燃烧时,若氧气不足生成一氧化碳,若充分燃烧生成二氧化碳,反应中放出的热量如图所示。(1)等质量的金刚石和石墨完全燃烧, (填“金刚石”
或“石墨”)放出的热量更多,写出表示石墨燃烧热的热化学方程式: 。
C(石墨,s)+O2(g)===CO2(g) ΔH=-393.5 kJ·ml-1
解析 根据图像,1 ml金刚石和石墨均完全燃烧生成二氧化碳,前者反应的ΔH=-395.4 kJ·ml-1,后者反应的ΔH=ΔH2+ΔH3=-393.5 kJ·ml-1,显然,金刚石放出的热量更多。根据燃烧热的概念,表示石墨燃烧热的热化学方程式中,生成物必须是二氧化碳。
(2)在通常状况下,_____(填“金刚石”或“石墨”)更稳定,写出石墨转化为金刚石的热化学方程式:____________________________________________________。
解析 根据图示可知 1 ml石墨的总能量比1 ml金刚石的总能量低1.9 kJ。据此可写出反应的热化学方程式。
===C(金刚石,s) ΔH=
+1.9 kJ·ml-1
(3)12 g石墨在一定量空气中燃烧,生成气体36 g,该过程中放出的热量为 。
解析 石墨的质量是12 g,根据C、O元素守恒可求出CO、CO2的物质的量均为0.5 ml。则反应放出的热量为0.5 ml×110.5 kJ·ml-1+0.5 ml×393.5 kJ·ml-1=252.0 kJ。
题组二 中和反应反应热的测定
4.利用如图所示装置测定中和反应反应热的实验步骤如下:①用量筒量取50 mL 0.50 ml·L-1盐酸倒入小烧杯中,测出盐酸温度;②用另一量筒量取50 mL 0.55 ml·L-1 NaOH溶液,并用同一温度计测出其温度;③将NaOH溶液倒入小烧杯中,设法使之混合均匀,测得混合液的最高温度。回答下列问题:(1)为什么所用NaOH溶液要稍过量? 。
解析 在中和反应反应热的测定实验中为了确保反应物被完全中和,常常使加入的一种反应物稍微过量一些。
(2)倒入NaOH溶液的正确操作是 (填字母)。A.沿玻璃棒缓慢倒入B.分三次倒入C.一次迅速倒入
解析 为了减少热量损失,倒入NaOH溶液应该一次迅速倒入。
(3)使盐酸与NaOH溶液混合均匀的正确操作是 (填字母)。A.用温度计小心搅拌B.揭开硬纸片用玻璃棒搅拌C.轻轻地振荡烧杯D.用套在温度计上的环形玻璃搅拌棒轻轻地搅动
解析 使盐酸与NaOH溶液混合均匀的正确操作:用套在温度计上的环形玻璃搅拌棒上下轻轻地搅动。
(4)现将一定量的稀氢氧化钠溶液、稀氢氧化钙溶液、稀氨水分别和1 L 1 ml·L-1的稀盐酸恰好完全反应,其反应热分别为ΔH1、ΔH2、ΔH3,则ΔH1、ΔH2、ΔH3的大小关系为 。
ΔH1=ΔH2<ΔH3
解析 稀氢氧化钠溶液和稀氢氧化钙溶液中溶质都完全电离,它们的中和反应反应热相同,稀氨水中的溶质是弱电解质,它与盐酸的反应中一水合氨的电离要吸收热量,故反应热的数值要小一些(注意中和反应反应热与ΔH的关系)。
(5)假设盐酸和氢氧化钠溶液的密度都是1 g·cm-3,又知中和反应后生成溶液的比热容c=4.18 J·g-1·℃-1。为了计算中和热,某学生实验记录数据如下:
依据该学生的实验数据计算,该实验测得的中和热ΔH=_____________(结果保留一位小数)。
-51.8 kJ·ml-1
解析 取三次实验的平均值代入公式计算即可。
(6)_____(填“能”或“不能”)用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸,理由是_______________________________________________________________________。
解析 硫酸与Ba(OH)2溶液反应生成BaSO4沉淀的生成热会影响中和反应的反应热,故不能用Ba(OH)2溶液和硫酸代替氢氧化钠溶液和盐酸。
H2SO4与Ba(OH)2反应生成BaSO4沉淀,沉淀的生成热会影响中和反应的反应热
(1)有关燃烧热的判断,一看是否以1 ml可燃物为标准,二看是否生成稳定氧化物。(2)中和反应的实质是H+和OH-反应生成H2O。若反应过程中有其他物质生成(如生成不溶性物质,难电离物质等),这部分反应热不在中和反应反应热之内。(3)对于中和反应反应热、燃烧热,由于它们的反应放热是确定的,所以描述中不带“-”,但焓变为负值。
1.盖斯定律(1)盖斯定律的内容不管化学反应是一步完成还是分几步完成,其反应热 ,即化学反应的反应热只与反应体系的 和 有关,而与反应的 无关。例如:C(s)+O2(g)===CO2(g) ΔH1
根据盖斯定律有: 。
ΔH1=ΔH2+ΔH3
(2)盖斯定律的应用①应用盖斯定律比较反应热的大小;②应用盖斯定律计算反应热。
2.反应热大小的比较(1)根据反应物的量的大小关系比较反应焓变大小①H2(g)+ O2(g)===H2O(g) ΔH1②2H2(g)+O2(g)===2H2O(g) ΔH2反应②中H2的量更多,因此放热更多,|ΔH1|
相关课件
这是一份2022年高考化学一轮复习课件 第6章 第29讲 化学能与热能 (含解析),共60页。PPT课件主要包含了复习目标,真题演练明确考向,课时精练巩固提高,内容索引,知识梳理·夯基础,kJ·mol-1,生成物,反应物,②活化能与焓变的关系,反应热等内容,欢迎下载使用。
这是一份高考化学一轮复习课件第6章第1讲 化学能与热能(含解析),共46页。PPT课件主要包含了知识点1,热效应,kJ·mol-1,kJmol,知识点2,物质的量,反应热,训练二十七等内容,欢迎下载使用。
这是一份2022高考化学一轮复习第6章化学反应与能量第1讲化学能与热能课件,共43页。PPT课件主要包含了知识点1,知识点2等内容,欢迎下载使用。








