






2022高考化学一轮复习(步步高)第八章 第40讲 盐类水解课件
展开1.了解盐类水解的原理及其一般规律。2.掌握水解离子方程式的书写。3.了解影响盐类水解程度的主要因素。4.了解盐类水解的应用。5.能利用水解常数(Kh)进行相关计算。
考点二 盐类水解的影响因素及应用
答题规范 5 利用平衡移动原理解释问题
考点一 盐类水解及其规律
微专题23 水解常数(Kh)与电离常数的关系及应用
H+或OH-结合生成弱电解质
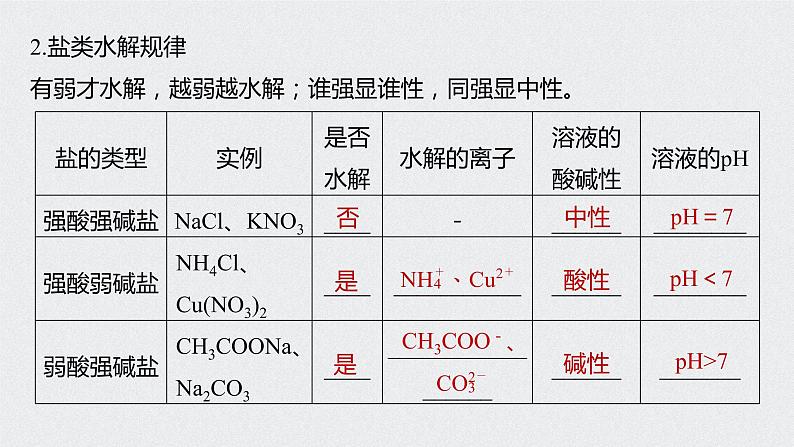
2.盐类水解规律有弱才水解,越弱越水解;谁强显谁性,同强显中性。
3.盐类水解离子方程式的书写(1)由于水解是微弱的反应,因而反应物与生成物用“ ”连接,易挥发性物质不标“↑”,难溶物不标“↓”,易分解的物质不拆开书写(相互促进水解者除外)。如NaHCO3(aq):___________________________。NH4Cl(aq):___________________________。(2)多元弱酸盐的水解分步写:如Na2S(aq):第一步:S2-+H2O HS-+OH-;第二步:HS-+H2O H2S+OH-,水解以第一步水解为主。
(3)金属阳离子(弱碱的阳离子)水解一步写到底:如AlCl3(aq):__________________________。(4)相互促进水解时,由于反应彻底,故生成物中出现的不溶于水的________或________均要注明状态,即写上“↓”或“↑”符号,中间用“===”连接。如NaHCO3与Al2(SO4)3混合反应: +Al3+===Al(OH)3↓+3CO2↑。
(1)溶液呈中性的盐一定是强酸、强碱生成的盐( )错因:______________________________________________________ 。(2)酸式盐溶液可能呈酸性,也可能呈碱性( )错因: 。(3)pH相同的盐酸和氯化铵溶液中由水电离出的c(H+)相同( )错因: 。
发生水解的盐溶液不一定呈酸性或碱性,也可能呈中性,如
酸抑制水的电离,盐类水解促进水的电离
(4)Na2CO3溶液中 ( )错因: 。(5)FeCl3溶液与NaHCO3溶液混合:Fe3++ ===Fe(OH)3↓+3CO2↑( )错因: 。
水解微弱,应该用可逆号
1.怎样用最简单的方法区别NaCl溶液、氯化铵溶液和碳酸钠溶液?答案 三种溶液各取少许分别滴入紫色石蕊溶液,不变色的为NaCl溶液,变红色的为氯化铵溶液,变蓝色的为碳酸钠溶液。
2.常温下,同浓度的①Na2CO3,②CH3COONa,③NaHCO3溶液,pH由大到小的顺序是__________。
3.已知常温下三种物质的电离常数,CH3COOH(Ka),NH3·H2O(Kb),H2CO3(Ka1)其关系为____________则CH3COONH4溶液显____性(填“酸”“碱”或“中”,下同),NH4HCO3溶液显____性。
题组一 盐类水解的实质及规律1.常温下,浓度均为0.1 ml·L-1的下列四种盐溶液,其pH测定如表所示:
下列说法正确的是 A.四种溶液中,水的电离程度:①>②>④>③B.Na2CO3和NaHCO3溶液中,粒子种类相同C.将等浓度的CH3COOH和HClO溶液比较,pH小的是HClOD.Na2CO3溶液中,
解析 这几种盐都是强碱弱酸盐,弱酸根离子发生水解反应使溶液显碱性,当盐的浓度相同时,酸的酸性越弱,酸根离子水解的程度就越大,水的电离程度就越大,溶液的碱性就越强。根据表格数据可知四种溶液中,水的电离程度:①<②<④<③,A错误;
在Na2CO3和NaHCO3溶液中,存在的粒子有Na+、 H2CO3、H2O、H+、OH-,所以粒子种类相同,B正确;
根据盐的水解程度大小可知,等浓度的CH3COOH和HClO溶液的酸性:CH3COOH>HClO,所以pH小的是CH3COOH,C错误;
在Na2CO3溶液中,根据物料守恒可得c(Na+)= +2c(H2CO3),D错误。
2.室温下,0.1 ml·L-1的NH4CN溶液的pH等于9.32,据此,下列说法错误的是 A.上述溶液能使甲基橙试剂变黄色B.室温下,NH3·H2O是比HCN更弱的电解质C.上述溶液中CN-的水解程度大于 的水解程度D.室温下,0.1 ml·L-1 NaCN溶液中,CN-的水解程度小于上述溶液中 CN-的水解程度
解析 室温下,溶液呈碱性,则溶液能使甲基橙试剂变黄色,故A正确;HCN和NH3·H2O均是弱电解质,溶液呈碱性,说明CN-的水解程度大于 的水解程度,由越弱越水解知NH3·H2O是比HCN强的电解质,故B错误,C正确;CN-、 相互促进水解,所以0.1 ml·L-1 NaCN溶液中,CN-的水解程度小于同浓度下NH4CN溶液中CN-的水解程度,故D正确。
3.A+、B+、C-、D-四种离子两两组成四种可溶性盐,其中:AC和BD盐溶液pH=7,BC盐溶液pH>7,则下列说法不正确的是 A.AD盐溶液pH<7B.在AC盐溶液中c(A+)+c(AOH)=c(C-)+c(HC)C.碱的电离程度一定是AOH>BOHD.酸的电离程度一定是HD>HC
解析 在盐类水解中,遵循“有弱就水解,越弱越水解,谁强显谁性,同强显中性”的规律,C项错误,D项正确;AD为强酸弱碱盐,显酸性,A项正确;由物料守恒可知,B项正确。
题组二 水解离子方程式的书写与判断4.下列物质在常温时发生水解,对应的离子方程式正确的是 A.Na2CO3:B.CuSO4:Cu2++2H2O===Cu(OH)2+2H+C.NaAlO2: +2H2O Al(OH)3+OH-D.NaF:F-+H2O===HF+OH-
5.写出下列物质常温下溶于水发生反应的离子方程式,判断指定溶液的酸碱性。(1)明矾___________________________,pH____7。(2) CH3COONH4____________________________________________,pH___7。(3) Al2S3__________________________________。
Al2S3+6H2O===2Al(OH)3↓+3H2S↑
6.解答下列问题(1)NaHS溶液呈碱性的原因__________________________________________________________________________________________________________________。(2)对于易溶于水的正盐MnRm溶液,已知只有一种离子可能水解,若pH>7,其原因是____________________________(用离子方程式说明,下同);若pH<7,其原因是______________________________。
NaHS溶液中存在:水解HS-+H2O H2S+OH-和电离HS- H++S2-两个平衡,其水解程度大于电离程度,因而溶液呈碱性
Rn-+H2O HR(n-1)-+OH-
Mm++mH2O M(OH)m+mH+
解析 pH大于7是由于弱酸酸根离子水解呈碱性,pH小于7是由于弱碱阳离子水解呈酸性。
1.判断酸式盐的水溶液的酸碱性要看该盐的构成微粒的实际表现。(1)强酸的酸式盐只电离,不水解,溶液一定显酸性,如:NaHSO4===Na++H++(2)弱酸的酸式盐溶液的酸碱性,取决于酸式酸根离子的电离程度和水解程度的相对大小。①电离程度小于水解程度,溶液显碱性,如NaHCO3溶液中:
使c(OH-)>c(H+),溶液显碱性。同理NaHS溶液、Na2HPO4溶液显碱性。
②电离程度大于水解程度,溶液显酸性,如NaHSO3溶液中: (主要) (次要)使c(H+)>c(OH-),溶液显酸性。同理NaH2PO4溶液显酸性。2. 等在水解时相互促进,其水解程度比单一离子的水解程度大,但水解程度仍然比较弱,不能进行完全,在书写水解方程式时用“ ”。
1.影响盐类水解平衡的因素(1)内因:生成盐的弱酸或弱碱越弱,其对应的弱酸酸根离子或弱碱阳离子的水解程度 ,溶液的碱性或酸性 。如水解程度:Na2CO3 Na2SO3,Na2CO3 NaHCO3。
溶液的浓度:浓度越小水解程度_____温度:温度越高水解程度_____
酸:弱酸酸根离子的水解程度 ,弱碱阳离子的水解程度_____碱:弱酸酸根离子的水解程度 ,弱碱阳离子的水解程度______
(3)以FeCl3水解为例:Fe3++3H2O Fe(OH)3+3H+,分析外界条件对水解平衡的影响。
生成红褐色沉淀,放出气体
2.盐类水解的应用(1)判断溶液的酸碱性Na2CO3溶液呈碱性的原因:
(2)配制或贮存易水解的盐溶液如配制FeCl3溶液时,先将它溶解在较浓的盐酸中,再加水至指定浓度;配制CuSO4溶液时,加入少量的H2SO4,以抑制Cu2+水解。(3)判断盐溶液蒸干灼烧时所得的产物如将AlCl3、FeCl3溶液蒸干后得到Al(OH)3、Fe(OH)3,灼烧得到Al2O3、Fe2O3;CuSO4溶液蒸干后得到CuSO4固体。
(5)解释生活中的现象如明矾净水、热纯碱溶液除油污,草木灰不能与铵盐混用、泡沫灭火器工作原理等。(6)离子浓度大小的比较如碳酸氢钠溶液中离子浓度大小顺序为c(Na+)>c( )>c(OH-)>c(H+)。
(7)物质的提纯(水解除杂)如MgCl2溶液中混有少量Fe3+杂质时,因Fe3+的水解程度比Mg2+的水解程度大,可加入MgO或Mg(OH)2等,使水解平衡右移,生成Fe(OH)3沉淀而除去。在酸性较强的环境中Fe3+比Al3+、Mg2+、Cu2+更易发生水解,可采用加入CuO、Cu(OH)2等调节pH的方法生成Fe(OH)3沉淀除去,但不能用会引入杂质离子的物质。
(1)稀溶液中,盐的浓度越小,水解程度越大,其溶液酸性(或碱性)也越强( )错因:________________________________________________________ __ 。(2)加热0.1 ml·L-1 Na2CO3溶液, 减小( )错因: 。
盐的浓度越小,水解程度越大,生成的H+(或OH-)的物质的量越多,但H+(或OH-)的浓度是减小的
(3)通入适量的HCl气体使FeCl3溶液中 增大( )错因:________________________________________________________ 。(4)水解相互促进的离子在同一溶液中一定不能共存( )错因:________________________________________________________ 。
通入HCl抑制了Fe3+的水解,Fe3+浓度增大的很少,Cl-浓度增大
水解相互促进没有沉淀和气体生成的离子可以共存,例如:铵根和醋酸根
题组一 水解平衡移动及结果分析1.向三份0.1 ml·L-1的CH3COONa溶液中分别加入少量NH4NO3、Na2SO3、FeCl2固体(忽略溶液体积变化),则CH3COO-浓度的变化依次为 A.减小、增大、减小 B.增大、减小、减小C.减小、增大、增大 D.增大、减小、增大
解析 CH3COONa溶液中存在水解平衡CH3COO-+H2O CH3COOH+OH-,加入的NH4NO3和FeCl2水解显酸性,故促进其平衡正向移动,则CH3COO-浓度减小;加入的Na2SO3水解显碱性,对水解有抑制作用,故CH3COO-浓度增大。
2.下列有关电解质溶液的说法不正确的是 A.向Na2CO3溶液中通入NH3,B.将0.1 ml·L-1的K2C2O4溶液从25 ℃升温至35 ℃,C.向0.1 ml·L-1的HF溶液中滴加NaOH溶液至中性,D.向0.1 ml·L-1的CH3COONa溶液中加入少量水,
3.(2020·长沙模拟)在一定条件下,Na2S溶液中存在水解平衡:S2-+H2O HS-+OH-。下列说法正确的是 A.稀释溶液,水解平衡常数增大B.加入CuSO4固体,HS-浓度减小C.升高温度, D.加入NaOH固体,溶液pH减小
解析 水解常数只与温度有关,A错误;Cu2++S2-===CuS↓,平衡左移,HS-浓度减小,B正确;水解为吸热反应,升高温度平衡右移,因而 增大,C错误;加入NaOH固体,溶液pH增大,D错误。
题组二 水解原理的应用4.下列有关问题与盐的水解有关的是 ①NH4Cl与ZnCl2溶液可作焊接金属时的除锈剂②NaHCO3与Al2(SO4)3两种溶液可作泡沫灭火剂③草木灰与铵态氮肥不能混合施用④实验室中盛放Na2CO3溶液的试剂瓶不能用磨口玻璃塞⑤加热蒸干CuCl2溶液得到Cu(OH)2固体⑥要除去FeCl3溶液中混有的Fe2+,可先通入氧化剂Cl2,再调节溶液的pHA.①②③⑥ B.②③④⑥C.①④⑤⑥ D.①②③④⑤
解析 ①NH4Cl和ZnCl2均为强酸弱碱盐,溶液中 与Zn2+均发生水解反应,溶液显酸性,可以除去金属表面的锈;② 与Al3+发生相互促进的水解反应,产生CO2,可作灭火剂;③草木灰的主要成分为K2CO3,水解显碱性,而铵态氮肥水解显酸性,因而二者不能混合施用;④Na2CO3溶液水解显碱性,而磨口玻璃塞中的二氧化硅会与碱反应生成Na2SiO3,将瓶塞与瓶口黏合在一起,因此实验室盛放Na2CO3溶液的试剂瓶应用橡胶塞;⑤CuCl2溶液中存在水解平衡,CuCl2+2H2O Cu(OH)2+2HCl,加热时,HCl挥发使平衡不断右移,最终得到Cu(OH)2固体;⑥Cl2能将Fe2+氧化成Fe3+,且没有引入杂质,与盐的水解无关。
5.下列根据反应原理设计的应用,不正确的是 A. 用热的纯碱溶液清洗油污B.Al3++3H2O Al(OH)3(胶体)+3H+ 明矾净水C.TiCl4+(x+2)H2O(过量) TiO2·xH2O↓+4HCl 用TiCl4制备TiO2D.SnCl2+H2O Sn(OH)Cl↓+HCl 配制氯化亚锡溶液时加入NaOH 固体
解析 升高温度,促使 的水解平衡正向移动,溶液中c(OH-)增大,碱性增强,有利于油污的水解及清洗,A正确;明矾是KAl(SO4)2·12H2O,Al3+发生水解生成Al(OH)3胶体,可吸附水中的悬浮杂质,起到净水作用,B正确;TiCl4发生水解反应生成TiO2·xH2O沉淀,经脱水制备TiO2,C正确;SnCl2易发生水解反应,而配制其溶液时,加入NaOH固体,消耗HCl促使水解平衡正向移动,生成Sn(OH)Cl沉淀,故应加入HCl溶液抑制其水解,D错误。
6.下列物质的水溶液在空气中小心加热蒸干至质量不再减少为止,能得到较纯净的原溶质的是 ①CuSO4 ②FeSO4 ③K2CO3 ④Ca(HCO3)2 ⑤NH4HCO3 ⑥KMnO4 ⑦FeCl3A.全部都可以 B.仅①②③C.仅①③⑥ D.仅①③
解析 FeSO4溶液加热过程中生成Fe(OH)2和H2SO4,又由于Fe(OH)2会被氧化生成Fe(OH)3,故蒸干后得到Fe2(SO4)3和Fe(OH)3的混合物;Ca(HCO3)2受热会分解生成CaCO3;NH3HCO3受热分解生成NH3、H2O、CO2;KMnO4受热分解生成K2MnO4和MnO2;FeCl3受热促进水解生成Fe(OH)3和盐酸,而盐酸挥发进一步促进其水解,最终水解彻底,受热分解得到的固体物质是Fe2O3。
题组三 平衡移动与实验探究7.已知:[FeCl4(H2O)2]-为黄色,溶液中可以存在可逆反应:Fe3++4Cl-+2H2O [FeCl4(H2O)2]-,下列实验所得结论不正确的是
注:加热为微热,忽略体积变化。A.实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3B.实验②中,酸化对Fe3+水解的影响程度大于温度的影响C.实验③中,加热,可逆反应:Fe3++4Cl-+2H2O [FeCl4(H2O)2]- 正向移动D.实验④,可证明升高温度,颜色变深一定是因为Fe3+水解平衡正向移动
解析 加热促进水解,铁离子水解生成氢氧化铁,则实验①中,Fe2(SO4)3溶液显浅黄色原因是Fe3+水解产生了少量Fe(OH)3,故A项正确;由Fe3++3H2O Fe(OH)3+3H+可知,酸化后加热溶液颜色无明显变化,氢离子抑制水解,则实验②中酸化对Fe3+水解的影响程度大于温度的影响,故B项正确;加入NaCl后,溶液立即变为黄色,发生反应:Fe3++4Cl-+2H2O [FeCl4(H2O)2]-,[FeCl4(H2O)2]-为黄色,加热时平衡正向移动,溶液颜色变深,故C项正确;实验④中存在Fe3++4Cl-+2H2O [FeCl4(H2O)2]-,升高温度平衡正向移动,溶液颜色变深,不能证明对Fe3+水解平衡的影响,故D项错误。
8.某同学在实验室探究NaHCO3的性质:常温下,配制0.10 ml·L-1 NaHCO3溶液,测得其pH为9.7;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是 A.NaHCO3溶液呈碱性的原因是 的水解程度大于电离程度B.加入CaCl2促进了 的水解C.反应的离子方程式为2 +Ca2+===CaCO3↓+H2CO3D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=
解析 NaHCO3既能电离又能水解,水解出OH-,电离出H+,NaHCO3溶液呈碱性的原因是 的水解程度大于其电离程度,A项正确;
盐溶液蒸干灼烧时所得产物的几种判断类型(1)盐溶液水解生成难挥发性酸时,蒸干后一般得原物质,如CuSO4(aq) CuSO4(s);盐溶液水解生成易挥发性酸时,蒸干灼烧后一般得对应的氧化物,如AlCl3(aq)Al(OH)3 Al2O3。(2)酸根离子易水解的强碱盐,如Na2CO3溶液等蒸干后可得到原物质。(3)考虑盐受热时是否分解。(4)还原性盐在蒸干时会被O2氧化,如Na2SO3(aq)Na2SO4(s)。
(1)解答此类题的思维过程①找出存在的平衡体系(即可逆反应或可逆过程)②找出影响平衡的条件③判断平衡移动的方向④分析平衡移动的结果及移动结果与所解答问题的联系(2)答题模板……存在……平衡,……(条件)……(变化),使平衡向……(方向)移动,……(结论)。
1.为探究盐类水解是一个吸热过程,请用Na2CO3溶液和其他必要试剂,设计一个简单的实验方案:____________________________________________________________________________________________。
取Na2CO3溶液,滴加酚酞溶液呈红色,然后分成两份,加热其中一份,若红色变深,则盐类水解吸热
2.常温下,0.1 ml·L-1 NaHCO3溶液的pH大于8,则溶液中c(H2CO3) (填“>”“=”或“<”) 原因是:____________________________________________________________________________(用离子方程式和必要的文字说明)。
的水解程度大于电离程度
3.(1)若在空气中加热MgCl2·6H2O,生成的是Mg(OH)Cl或MgO,写出相应反应的化学方程式: , 或 。(2)在干燥的HCl气流中加热MgCl2·6H2O时,能得到无水MgCl2,其原因是____________________________________________________________ 。
在干燥的HCl气流中,抑制了MgCl2的水解,且带走MgCl2·6H2O受热产生的水蒸气,故能得到无水MgCl2
4.(1)把AlCl3溶液蒸干灼烧,最后得到的主要固体是什么?为什么?如何操作溶质不变?(用化学方程式表示并配以必要的文字说明)。
答案 在AlCl3溶液中存在着如下平衡:AlCl3+3H2O Al(OH)3+3HCl,加热时水解平衡右移,HCl浓度增大,蒸干时HCl挥发,使平衡进一步向右移动得到Al(OH)3,在灼烧时发生反应2Al(OH)3 Al2O3+3H2O,因此最后得到的固体是Al2O3;在HCl气流中加热蒸发溶质不变。
(2)MgO可除去MgCl2溶液中的Fe3+,其原理是____________________________________________________________________________________________________。
Fe3++H2O Fe(OH)3+3H+,加入MgO,MgO和H+反应,使c(H+)减小,平衡右移,生成Fe(OH)3沉淀除去
1.(2020·天津,7)常温下,下列有关电解质溶液的说法错误的是 A.相同浓度的HCOONa和NaF两溶液,前者的pH较大,则Ka(HCOOH)> Ka(HF)B.相同浓度的CH3COOH和CH3COONa两溶液等体积混合后pH约为4.7, 则溶液中c(CH3COO-)>c(Na+)>c(H+)>c(OH-)C.FeS溶于稀硫酸,而CuS不溶于稀硫酸,则Ksp(FeS)>Ksp(CuS)D.在1 ml·L-1 Na2S溶液中,c(S2-)+c(HS-)+c(H2S)=1 ml·L-1
解析 HCOONa和NaF均属于强碱弱酸盐,越弱越水解,HCOONa的pH较大,所以Ka(HCOOH)<Ka(HF),A项错误;两溶液等体积混合后pH<7,说明溶液显酸性,c(H+)>c(OH-),醋酸的电离程度大于醋酸根离子的水解程度,则c(CH3COO-)>c(Na+)>c(H+)>c(OH-),B项正确;硫化亚铁溶于稀硫酸,而硫化铜不溶于稀硫酸,可得Ksp(FeS)>Ksp(CuS),C项正确;在1 ml·L-1的Na2S溶液中,根据物料守恒可得c(S2-)+c(HS-)+c(H2S)=1 ml·L-1,D项正确。
2.(2019·上海,20)常温下0.1 ml·L-1①CH3COOH、②NaOH、③CH3COONa,下列叙述正确的是 A.①中c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)B.①②等体积混合后,醋酸根离子浓度小于③的二分之一C.①③等体积混合以后,溶液呈酸性,则c(Na+)>c(CH3COO-)>c(H+)D.①②等体积混合后水的电离程度比①③等体积混合后水的电离程度小
解析 A项,0.1 ml·L-1 CH3COOH发生部分电离产生CH3COO-和H+,水发生微弱电离产生H+和OH-,故①中c(CH3COOH)>c(H+)>c(CH3COO-)>c(OH-),错误;B项,①②等体积混合后恰好反应生成CH3COONa,且c(CH3COONa)=0.05 ml·L-1,由于①②混合后c(CH3COONa)小于③,则混合液中CH3COO-的水解程度比③大,故混合液中c(CH3COO-)小于③中 c(CH3COO-),正确;
C项,①③等体积混合后为等物质的量的CH3COOH和CH3COONa的混合溶液,溶液显酸性说明CH3COOH的电离程度大于CH3COO-的水解程度,则c(CH3COO-)>c(Na+)>c(H+),错误;D项,①②等体积混合后恰好生成CH3COONa,CH3COO-水解促进水的电离,①③等体积混合后,由于CH3COOH电离程度大于CH3COO-的水解程度,水的电离被抑制,故①②等体积混合后水的电离程度比①③等体积混合后水的电离程度大,错误。
3.(2016·全国卷Ⅲ,13)下列有关电解质溶液的说法正确的是 A.向0.1 ml·L-1 CH3COOH溶液中加入少量水,溶液中B.将CH3COONa溶液从20 ℃升温至30 ℃,溶液中C.向盐酸中加入氨水至中性,溶液中D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
4.(2019·北京,12)实验测得0.5 ml·L-1CH3COONa溶液、0.5 ml·L-1CuSO4溶液以及H2O的pH随温度变化的曲线如图所示。下列说法正确的是 A.随温度升高,纯水中c(H+)>c(OH-)B.随温度升高,CH3COONa溶液的c(OH-)减小C.随温度升高,CuSO4溶液的pH变化是Kw改变与水解 平衡移动共同作用的结果D.随温度升高,CH3COONa溶液和CuSO4溶液的 pH均降低,是因为CH3COO-、Cu2+水解平衡移动方向不同
解析 任何温度时,纯水中H+浓度与OH-浓度始终相等,A项错误;随温度升高,CH3COONa水解程度增大,溶液中c(OH-)增大,且温度升高,水的电离程度增大,c(OH-)也增大,B项错误;
温度升高,水的电离程度增大,c(H+)增大,又CuSO4水解使溶液显酸性,温度升高,水解平衡正向移动,故c(H+)增大,C项正确;温度升高,能使电离平衡和水解平衡均正向移动,而CH3COONa溶液随温度升高pH降低的原因是水的电离程度增大得多,而CuSO4溶液随温度升高pH降低的原因是Cu2+水解程度增大得多,D项错误。
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。下列说法不正确的是 A.Na2SO3溶液中存在水解平衡: B.④的pH与①不同,是由 浓度减小造成的C.①→③的过程中,温度和浓度对水解平衡移动方向的影响一致D.①与④的Kw值相等
5.(2018·北京,11)测定0.1 ml·L-1Na2SO3溶液先升温再降温过程中的pH,数据如下。
Kw只与温度有关,D对。
1.(2019·怀化高三期末)常温下,某NH4Cl溶液的pH=4,下列说法中正确的是 ①溶液中c(H+)>c(OH-)②由水电离产生的c(H+)约为10-10 ml·L-1③溶液中离子浓度关系为c(Cl-)>c( )>c(H+)>c(OH-)④在纯水中加入该NH4Cl溶液,水的电离被抑制A.①② B.①③ C.①④ D.①②③④
2.室温下,将0.05 ml Na2CO3固体溶于水配成100 mL溶液,向溶液中加入下列物质,有关结论正确的是
D项,加入0.1 ml NaHSO4固体与0.05 ml Na2CO3恰好反应生成0.1 ml Na2SO4,溶液呈中性,故溶液pH减小,加入NaHSO4,引入Na+,所以c(Na+)增大,错误
3.下列溶液中,操作和现象对应正确的是
解析 明矾溶液中Al3+水解使溶液呈酸性,加热,Al3+的水解程度增大,溶液的酸性增强,无颜色变化,A项错误;加入NH4Cl固体,氨水的电离程度减小,碱性减弱,溶液颜色变浅,B项正确;加入少量CH3COONa固体会使CH3COO-+H2O CH3COOH+OH-平衡向右移动,c(OH-)增大,颜色变深,C项错误;加热氯化铁溶液时促进FeCl3水解为红褐色的Fe(OH)3,颜色加深,D项错误。
4.常温下,HF的电离常数Ka=6.61×10-4,NH3·H2O的电离常数Kb=1.78×10-5。下列说法正确的是 A.NH4F溶液中B.NH4F溶液中水的电离程度小于纯水的电离程度C.NH4F溶液中F-的水解平衡常数Kh(F-)≈1.51×10-11D.NH4F与NH4Cl的混合溶液中有下列关系:
解析 HF的电离平衡常数大于NH3·H2O的电离平衡常数,所以氟离子的水解程度小于铵根离子水解程度,溶液显酸性,氢氧根离子与氢离子的比值的对数应小于0,故A项错误;铵根离子和氟离子的水解促进水的电离,所以NH4F溶液中水的电离程度大于纯水的电离程度,故B项错误;NH4F溶液中F-的水解平衡常数= ≈1.51×10-11,故C项正确;
5.下列有关电解质溶液的说法正确的是 A.将Ca(ClO)2、Na2SO3、FeCl3溶液蒸干均得不到原溶质B.保存氯化亚铁溶液时,在溶液中放少量铁粉,以防止Fe2+水解C.室温下,向0.1 ml·L-1的CH3COOH溶液中加入少量水溶液显碱性的 物质,CH3COOH的电离程度一定增大D.NaCl溶液和CH3COONH4溶液均显中性,两溶液中水的电离程度相同
解析 Ca(ClO)2在水中发生水解:Ca(ClO)2+2H2O Ca(OH)2+2HClO,HClO不稳定,受热会分解:2HClO 2HCl+O2↑,生成的HCl会和Ca(OH)2反应生成CaCl2和H2O,故加热蒸干Ca(ClO)2溶液得不到Ca(ClO)2固体;加热Na2SO3溶液的过程中,发生反应:2Na2SO3+O2===2Na2SO4,蒸干会得到Na2SO4固体,加热FeCl3溶液,FeCl3发生水解反应:FeCl3+3H2O===Fe(OH)3+3HCl,HCl挥发,故加热蒸干会得到Fe(OH)3固体,A项正确;保存氯化亚铁溶液时,在溶液中放少量铁粉,可防止Fe2+被氧化为Fe3+,B项错误;
水溶液显碱性的物质不一定是碱,如强碱弱酸盐CH3COONa,其水溶液显碱性,CH3COOH溶液中加入少量CH3COONa,CH3COO-浓度增大,会抑制CH3COOH的电离,使CH3COOH的电离程度减小,C项错误;CH3COONH4能发生相互促进的水解反应,CH3COO-、 的水解均会促进水的电离,溶液中水的电离程度越大,但溶液中的H+浓度与OH-浓度相等,故溶液呈中性,D项错误。
6.已知常温下弱酸的电离平衡常数H2CO3:Ka1=4.3×10-7,Ka2=5.6×10-11;HClO:Ka=2.95×10-8;H2SO3:Ka1=1.54×10-2,Ka2=1.02×10-7。下列说法错误的是 A.同浓度NaHCO3、NaClO、NaHSO3溶液的pH关系:NaClO>NaHCO3 >NaHSO3B.将足量SO2通入NaClO溶液中反应的离子方程式为SO2+ClO-+H2O ===HClO+C.NaHSO3溶液中微粒浓度关系:D.NaHCO3稀溶液中存在:
解析 SO2和NaClO发生氧化还原反应:SO2+H2O+ClO-=== +Cl-+2H+,故B错误;由K值可知 的电离程度大于水解程度,故C正确;根据电荷守恒和物料守恒可推出D正确。
7.(2019·宜昌第一中学模拟)广义的水解观认为水解的物质和水分别离解成两部分,然后两两重新结合成新的物质,不出现元素化合价的变化。根据以上信息,下列物质水解后的产物错误的是 A.BaO2的水解产物是Ba(OH)2和H2O2B.BrCl水解的产物是HClO和HBrC.Mg2C3水解的产物是Mg(OH)2和C3H4D.Al2S3水解的产物是Al(OH)3和H2S
解析 A项,BaO2的水解产物是Ba(OH)2和H2O2,该反应中没有元素化合价升降,符合水解原理;B项,该反应中氯元素化合价从-1变为+1,溴元素的化合价从+1变为-1,有电子转移,不符合水解原理;C项,Mg2C3水解生成Mg(OH)2和C3H4,该反应中没有元素化合价变化,符合水解原理;D项,Al2S3水解为Al(OH)3和H2S,没有化合价变化,符合水解原理。
8.25 ℃时,下列各组数据中比值为2∶1的是 A.0.2 ml·L-1的CH3COONa溶液与0.1 ml·L-1的CH3COONa溶液中 c(CH3COO-)之比B.pH=7的氨水与(NH4)2SO4的混合溶液中C.等质量的碳酸钠固体和碳酸氢钠固体分别与足量盐酸反应,消耗盐酸 的物质的量之比D.pH均为2的H2SO4溶液与盐酸中c(H+)之比
解析 前者c(CH3COO-)和后者c(CH3COO-)的比值大于2∶1,A项错误;
根据反应Na2CO3+2HCl===2NaCl+CO2↑+H2O和NaHCO3+HCl===NaCl+CO2↑+H2O可知,等质量的Na2CO3和NaHCO3与盐酸反应,消耗盐酸物质的量之比不等于2∶1,C项错误;因为两溶液pH均为2,因此两酸中c(H+)相等,D项错误。
9.已知常温下浓度均为0.1 ml·L-1的溶液的pH如下表所示:
下列有关说法正确的是 A.根据如表得出三种酸的电离平衡常数: HF>HClO>H2CO3(一级电离平衡常数)B.加热0.1 ml·L-1 NaClO溶液,其pH将小于=2的HF溶液与pH=12的NaOH溶液以等体积混合,则有c(Na+)= c(F-)>c(H+)=c(OH-)D.0.1 ml·L-1 Na2CO3溶液中:c(OH-)-c(H+)=c( )+2c(H2CO3)
解析 相同温度下,相同浓度的钠盐溶液中,弱酸酸根离子水解程度越大其溶液pH越大。根据表中数据可知,离子水解程度:F-<ClO-< ,则酸的电离平衡常数HF>HClO> A项错误;盐类水解是吸热反应,升高温度促进盐类水解,故加热NaClO溶液,ClO-水解程度增大,溶液的碱性增强,pH增大,B项错误;常温下,NaF溶液的pH=7.5>7,说明NaF是强碱弱酸盐,则HF是弱酸,pH=2的HF浓度大于pH=12的NaOH溶液浓度,二者等体积混合,HF有剩余,溶液呈酸性,则c(H+)>c(OH-),结合电荷守恒得c(Na+)<c(F-),酸的电离程度较小,则溶液中离子浓度c(F-)>c(Na+)>c(H+)>c(OH-),C项错误;
10.(2020·淮安模拟)已知NaHSO3溶液常温时显酸性,溶液中存在以下平衡:①②
11.在NaCN溶液中存在水解平衡:CN-+H2O HCN+OH-,水解常数Kh(NaCN)=[c0(NaCN)是NaCN溶液的起始浓度]。25 ℃时,向1 ml·L-1的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH=-lgc(OH-)]的关系如图所示,下列说法中错误的是
A.25 ℃时,Kh(NaCN)的值为10-4.7B.升高温度,可使曲线上a点变到b点C.25 ℃,向a点对应的溶液中加入固体NaCN, CN-的水解程度减小D.c点对应溶液中的c(OH-)大于a点
升高温度,促进CN-的水解,OH-浓度增大,则2pOH的值减小,B项错误;加入NaCN固体,CN-浓度增大,水解平衡正向移动,但CN-水解的程度减小,C项正确;pOH是OH-浓度的负对数,因c点的pOH小于a点,所以c点OH-的浓度大于a点,D项正确。
12.(2020·沈阳模拟)常温下,向1 L 0.1 ml·L-1 H2A溶液中逐滴加入等浓度NaOH溶液,所得溶液中含A元素的微粒的物质的量分数与溶液pH的关系如图,下列说法中正确的是
A.Na2A的水解离子方程式为A2-+H2O HA- +OH-,HA-+H2O H2A+OH-B.室温下,Na2A水解平衡常数Kh=10-11
C.0.1 ml·L-1 NaHA溶液中存在c(A2-)+c(HA-)<0.1 ml·L-1D.常温下,等物质的量浓度的NaHA与Na2A溶液等体积混合后溶液的pH =3.0
解析 由图像可知,0.1 ml·L-1 H2A溶液全部电离为HA-,说明第一步电离为完全电离,HA-不水解,故A错误;
H2A溶液全部电离,不存在H2A分子,则由物料守恒可知,c(A2-)+c(HA-)=0.1 ml·L-1,故C错误;
13.NH4Al(SO4)2是食品加工中最为快捷的食品添加剂,用于焙烤食品;NH4HSO4在分析试剂、医药、电子工业中用途广泛。请回答下列问题:(1)NH4Al(SO4)2可作净水剂,其理由是_______________________________________________________________________________________________________________________(用必要的化学用语和相关文字说明)。
Al3+水解生成的Al(OH)3胶体具有吸附性,即Al3++3H2O Al(OH)3(胶体)+3H+,Al(OH)3胶体吸附悬浮颗粒使其沉降从而净化水
(2)相同条件下,0.1 ml·L-1NH4Al(SO4)2溶液中c( )________(填“等于”“大于”或“小于”)0.1 ml·L-1NH4HSO4溶液中c( )。
①其中符合0.1 ml·L-1 NH4Al(SO4)2溶液的pH随温度变化的曲线是__(填字母),导致pH随温度变化的原因是_________________________________________________________________。
(3)如图1所示是0.1 ml·L-1电解质溶液的pH随温度变化的图像。
NH4Al(SO4)2水解,溶液呈酸性,升高温度使其水解程度增大,pH减小
解析 NH4Al(SO4)2水解,溶液呈酸性,升高温度其水解程度增大,pH减小,符合的曲线为Ⅰ。
10-3 ml·L-1
(4)室温时,向100 mL 0.1 ml·L-1NH4HSO4溶液中滴加0.1 ml·L-1NaOH溶液,所得溶液pH与NaOH溶液体积的关系曲线如图2所示。试分析图中a、b、c、d四个点,水的电离程度最大的是____点;在b点,溶液中各离子浓度由大到小的排列顺序是__________________________________。
14.Ⅰ.(1)KAl(SO4)2溶液蒸干得到的固体物质是________________,原因是_______________________________________________________________________________________。(2)FeCl2溶液蒸干灼烧得到的固体物质是_____,原因是_______________________________________________________________________________________________________________。(3)将0.5 ml·L-1的NaClO溶液加热蒸干灼烧最后所得的固体是________,原因是______________________________________________________________________________________________________________________。
KAl(SO4)2·12H2O
尽管Al3+水解,但由于H2SO4为难挥发性酸,最后仍然得到明矾。注意温度过高,会脱去结晶水
Fe2+水解生成Fe(OH)2和HCl,在加热蒸干过程中HCl挥发,Fe(OH)2逐渐被氧化生成Fe(OH)3,Fe(OH)3灼烧分解生成Fe2O3
NaClO水解的化学方程式为NaClO+H2O NaOH+HClO,2HClO 2HCl+O2↑,HCl+NaOH===NaCl+H2O,最终得到NaCl
Ⅱ.[2015·天津理综,10(3)(4)]FeCl3具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3高效,且腐蚀性小。请回答下列问题:FeCl3在溶液中分三步水解:
欲使平衡正向移动可采用的方法是_____(填字母)。a.降温 b.加水稀释c.加入NH4Cl d.加入NaHCO3室温下,使氯化铁溶液转化为高浓度聚合氯化铁的关键条件是________________。
新高考化学一轮复习课件 第8章 第49讲 盐类的水解: 这是一份新高考化学一轮复习课件 第8章 第49讲 盐类的水解,共60页。PPT课件主要包含了高考化学一轮复习策略,盐类的水解,盐类的水解及其规律,真题演练明确考向,课时精练等内容,欢迎下载使用。
2022年高考化学一轮复习课件 第8章 第40讲 盐类水解 (含解析): 这是一份2022年高考化学一轮复习课件 第8章 第40讲 盐类水解 (含解析),共60页。PPT课件主要包含了复习目标,内容索引,真题演练明确考向,课时精练巩固提高,知识梳理·夯基础,盐类的水解,pH=7,pH<7,pH7,错误的写明原因等内容,欢迎下载使用。
高考化学一轮复习课件第8章第4讲 盐类的水解(含解析): 这是一份高考化学一轮复习课件第8章第4讲 盐类的水解(含解析),共46页。PPT课件主要包含了知识点1,pH=7,pH<7,pH7,知识点2,HCl,MgO,知识点3,训练四十一等内容,欢迎下载使用。












